题目内容
10.下列有关叙述中不正确的是( )| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在离原子核越近的区域运动的电子,能量越低 | |
| C. | 1869年俄国化学家门捷列夫经研究提出了元素周期律,并列出了第一张元素周期表 | |
| D. | 因为一个铝原子比一个钠原子失去电子数目多,所以铝单质比钠单质还原性强 |
分析 A.在金属元素与非金属元素的分界线附近的元素既有金属性又有非金属性;
B.能量越低,越不容易脱离原子核的束缚;
C.1869年俄国化学家门捷列夫最先发现元素周期律并绘制第一张元素周期表;
D.金属还原性强弱与失电子的多少无关,与失电子的难易程度有关.
解答 解:A.因在金属元素与非金属元素的分界线附近的元素既有金属性又有非金属性,则可以制备半导体材料,故A正确;
B.能量越低越不容易脱离原子核的束缚,能量越高越容易脱离原子核的束缚,故能量低的电子在离原子核越近的区域运动,能量高的电子在离原子核远的区域运动,故B正确;
C.1869年俄国化学家门捷列夫最先发现元素周期律并绘制第一张元素周期表,故C正确;
D.金属还原性强弱与失电子的多少无关,与失电子的难易程度有关,钠比铝易失电子,所以钠的金属性强于铝,故D正确;
故选D.
点评 本题考查元素周期律与元素周期律及其应用、核外电子排布规律、金刚石结构等,难度不大,注意识记中学常见晶体结构.

练习册系列答案
相关题目
20.下列反应既属于非氧化还原反应,又属于吸热反应的是( )
| A. | 铝片和稀盐酸反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | 甲烷在氧气中的燃烧 |
1.第3周期元素R,它的原子核外层上达到饱和所需电子数小于次外层和最内层电子数之差,且等于最内层电子数的正整数倍.则关于R的正确说法是( )
| A. | 常温下,能稳定存在的R的高价氧化物都能与烧碱溶液反应 | |
| B. | R的最高价氧化物对应水化物是强酸 | |
| C. | R和R的氧化物的熔点和硬度都很高 | |
| D. | R能形成稳定的气态氢化物 |
18.乙醇、甘油和苯酚的共同点是( )
| A. | 分子结构中都含有羟基,都能与Na反应,产生H2 | |
| B. | 常温下都是无色液体 | |
| C. | 与FeCl3溶液反应呈紫色 | |
| D. | 都能与NaOH溶液发生中和反应 |
5.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
| A. | 原子半径的大小顺序为:rZ>rW>rY>rX | |
| B. | 离子Y2-和X3-的核外电子数和电子层数都不相同 | |
| C. | 物质WY2、WZ4均有熔点高、硬度大的特性 | |
| D. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
2.能源、环境与人类生活密切相关,研究它们的综合利用有重要意义.
Ⅰ.二甲醚可代替汽油作新型清洁燃料.常温常压下,二氧化碳加氢可选择性生产二甲醚(CH3OCH3)或一氧化碳.已知二甲醚、氢气的燃烧热分别为-1455kJ/mol,-285.8kJ/mol
(1)写出CO2加氢转化为CH3OCH3(g)和H2O(l)的热化学方程式2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(l)△H=-259.8kJ•mol-1,该反应的平衡常数的表达式为)
$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$..
(2)等物质的量的CO和H2在一定条件下可合成CH3OCH3,同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为:3CO+3H2═CH3OCH3+CO2.
(3)二甲醚燃料电池原理如图1所示
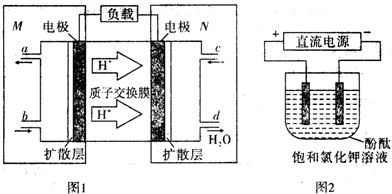
①M区发生的电极反应式为CH3OCH3+3H2O-12e-=2CO2+12H+.
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗CH3OCH3的质量为0.24g(假设溶液电解前后体积不变,保留2位有效数字).
Ⅱ.硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1
(1)下列说法中可以说明该反应已达到平衡状态的是bd
a.体系内混合气体的密度保持不变 h.v(NO2)正=v(SO3)逆
c.容器内气体的总压强保持不变 d.NO体积分数不再改变
(2)某温度下,NO2(g)+SO2(g)?SO3(g)+NO(g)的平衡常数K=$\frac{9}{4}$,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如表所示,
①10min后,甲中达到平衡,则甲中反应的平均速率v(NO2)=0.006mol/(L•min).
②丙达到平衡所用的时间<10min(填“<”“>”“=”),达到平衡后,设甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为a=c<b.
Ⅰ.二甲醚可代替汽油作新型清洁燃料.常温常压下,二氧化碳加氢可选择性生产二甲醚(CH3OCH3)或一氧化碳.已知二甲醚、氢气的燃烧热分别为-1455kJ/mol,-285.8kJ/mol
(1)写出CO2加氢转化为CH3OCH3(g)和H2O(l)的热化学方程式2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(l)△H=-259.8kJ•mol-1,该反应的平衡常数的表达式为)
$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$..
(2)等物质的量的CO和H2在一定条件下可合成CH3OCH3,同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为:3CO+3H2═CH3OCH3+CO2.
(3)二甲醚燃料电池原理如图1所示

①M区发生的电极反应式为CH3OCH3+3H2O-12e-=2CO2+12H+.
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗CH3OCH3的质量为0.24g(假设溶液电解前后体积不变,保留2位有效数字).
Ⅱ.硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1
(1)下列说法中可以说明该反应已达到平衡状态的是bd
a.体系内混合气体的密度保持不变 h.v(NO2)正=v(SO3)逆
c.容器内气体的总压强保持不变 d.NO体积分数不再改变
(2)某温度下,NO2(g)+SO2(g)?SO3(g)+NO(g)的平衡常数K=$\frac{9}{4}$,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如表所示,
| 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| c(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
②丙达到平衡所用的时间<10min(填“<”“>”“=”),达到平衡后,设甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为a=c<b.
19.在酸性溶液中,下列各组离子可能共存的是( )
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、NO3-、HCO3- | ||
| C. | SO42-、Fe3+、K+、Cl- | D. | NO3-、K+、SO32-、Mg2+ |