题目内容
已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,若该溶液中含有两种溶质,则这四种离子浓度大小顺序可能是( )
①c(CH3COO-)>c(Na+)>c(OH-)>c(H+) ②c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③c(Na+)=c(CH3COO-)>c(OH-)=c(H+) ④c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
①c(CH3COO-)>c(Na+)>c(OH-)>c(H+) ②c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③c(Na+)=c(CH3COO-)>c(OH-)=c(H+) ④c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
| A、①② | B、①③ | C、②④ | D、③④ |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,若该溶液中含有两种溶质,该溶液中的溶质可能为醋酸和醋酸钠、醋酸钠和NaOH,溶液中存在电荷守恒和物料守恒,据此分析解答.
解答:
解:某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,若该溶液中含有两种溶质,该溶液中的溶质可能为醋酸和醋酸钠、醋酸钠和NaOH,
①如果溶液中存在c(OH-)>c(H+),根据电荷守恒得c(CH3COO-)<c(Na+),故错误;
②如果溶液中存在c(H+)>c(OH-),根据电荷守恒得c(Na+)<c(CH3COO-),故错误;
③如果溶液中存在c(OH-)=c(H+),根据电荷守恒得c(Na+)=c(CH3COO-),且水的电离程度很小,所以溶液中存在c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故正确;
④如果溶液中溶质为氢氧化钠和醋酸钠,且NaOH浓度大于醋酸钠,离子浓度大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故正确;
故选D.
①如果溶液中存在c(OH-)>c(H+),根据电荷守恒得c(CH3COO-)<c(Na+),故错误;
②如果溶液中存在c(H+)>c(OH-),根据电荷守恒得c(Na+)<c(CH3COO-),故错误;
③如果溶液中存在c(OH-)=c(H+),根据电荷守恒得c(Na+)=c(CH3COO-),且水的电离程度很小,所以溶液中存在c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故正确;
④如果溶液中溶质为氢氧化钠和醋酸钠,且NaOH浓度大于醋酸钠,离子浓度大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故正确;
故选D.
点评:本题考查了离子浓度大小比较,根据溶质的性质再结合守恒思想分析解答即可,同时考查学生发散思维能力,题目难度不大.

练习册系列答案
相关题目
实验室中需要配制2mol/L的NaOH溶液950mL,配制 时应选用的容量瓶的规格和称取的NaOH的质量分别是( )
| A、950 mL,78 g |
| B、500 ml,80g |
| C、1 000 mL,80 g |
| D、1 000 mI.,76 g |
下列物质:①BeCl2②SiC③白磷④BF3⑤NH3⑥过氧化氢其中含极性键的非极性分子是( )
| A、①③④ | B、②③⑥ |
| C、①④ | D、①③④⑤ |
下列同组中的两种物质,属于官能团异构的是( )
| A、CH3CH2CH2OH和 CH3CH(OH)CH3 |
| B、CH3 CH(CH3)2和 CH3 CH2CH2CH3 |
| C、CH3CH2CHO和 CH3COCH3 |
| D、CH2=CHCH2CH2CH3和CH3CH2CH=CHCH3 |
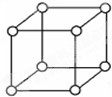 查资料表知,只有钋的晶体中的原子具有如图所示的堆积方式,钋的外围电子排布式是6s26p4.下列关于钋的说法错误的是( )
查资料表知,只有钋的晶体中的原子具有如图所示的堆积方式,钋的外围电子排布式是6s26p4.下列关于钋的说法错误的是( )| A、右图的堆积方式空间利用率太低,金属极少采取这种堆积方式 |
| B、钋晶体中原子的配位数为 6 |
| C、钋基态原子的能层数=周期序数=价电子数 |
| D、钋的常见化合价为+4、+6、-2价 |
某苯的衍生物只含有两个互为对位的取代基,其分子式为C9H12O,其中不能与氢氧化钠反应的衍生物的结构式有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
下列有关实验装置进行的相应实验,不能达到实验目的是( )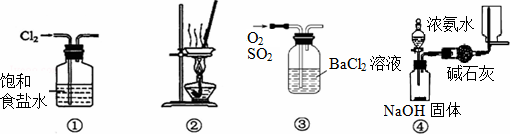

| A、用装置①除去Cl2中含有的少量HCl |
| B、用装置②从KCl溶液中获得KCl晶体 |
| C、用装置③除去O2中混有的一定量SO2 |
| D、用装置④在实验室制取并收集氨气 |