题目内容
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和KCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,Y电极反应式是
(2)若X、Y都是银电极,a是稀硝酸银溶液,开始实验,X极的电极反应式是
Y电极的电极反应式是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)若X、Y都是惰性电极,a是饱和KCl溶液,Y为阳极电极上氯离子放电生成氯气,发生氧化反应,氯气可以用湿润的淀粉碘化钾试纸检验,X为阴极电极上氢离子放电生成氢气,同时该电极附近生成氢氧根离子,遇到酚酞试液会变红;
(2)若X、Y都是银电极,a是稀硝酸银溶液,开始实验,X为阴极电极上银离子放电生成银,Y为阳极电极上银本身失电子放电生成银离子,发生氧化反应,电解前后硝酸银溶液的浓度不变;根据电极反应计算电子转移.
(2)若X、Y都是银电极,a是稀硝酸银溶液,开始实验,X为阴极电极上银离子放电生成银,Y为阳极电极上银本身失电子放电生成银离子,发生氧化反应,电解前后硝酸银溶液的浓度不变;根据电极反应计算电子转移.
解答:
解:(1)①若X、Y都是惰性电极,a是饱和KCl溶液,Y电极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,发生氧化反应,氯气具有氧化性,能氧化碘离子生成碘单质,碘遇淀粉试液变蓝色,所以氯气可以用湿润的淀粉碘化钾试纸检验,X为阴极电极上氢离子放电生成氢气,电极反应式为2H++2e-=H2↑,同时该电极附近生成氢氧根离子,遇到酚酞试液会变红;
故答案为:2Cl--2e-=Cl2↑;氧化;溶液会变红;2H++2e-=H2↑;将湿润的淀粉碘化钾试纸接近出气口,如果试纸变蓝色就说明生成氯气;
(2)若X、Y都是银电极,a是稀硝酸银溶液,开始实验,X为阴极电极上银离子放电生成银,电极反应式为Ag++e-=Ag,Y为阳极电极上银本身失电子放电生成银离子,电极反应式为Ag-e-=Ag+,发生氧化反应,由阴阳极的电极反应得电解前后硝酸银溶液的浓度不变;若某电极质量增重108克,根据阴极反应方程式Ag++e-=Ag,则在电路中电子转移为
=1mol;故答案为:Ag++e-=Ag;Ag-e-=Ag+;不变;1.
故答案为:2Cl--2e-=Cl2↑;氧化;溶液会变红;2H++2e-=H2↑;将湿润的淀粉碘化钾试纸接近出气口,如果试纸变蓝色就说明生成氯气;
(2)若X、Y都是银电极,a是稀硝酸银溶液,开始实验,X为阴极电极上银离子放电生成银,电极反应式为Ag++e-=Ag,Y为阳极电极上银本身失电子放电生成银离子,电极反应式为Ag-e-=Ag+,发生氧化反应,由阴阳极的电极反应得电解前后硝酸银溶液的浓度不变;若某电极质量增重108克,根据阴极反应方程式Ag++e-=Ag,则在电路中电子转移为
| 108g |
| 108g/mol |
点评:本题考查原电池原理,涉及电极反应式的书写、氯气的检验等知识点,知道离子放电顺序及电极反应式的书写方法、氯气的检验方法及现象,学会应用电解池中氧化还原反应的得失电子守恒进行有关计算即可,题目难度不大.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
下列说法不正确的是( )
| A、钠、铁和铜一样都能在氯气中燃烧生成金属氯化物 |
| B、液氯是氯气的水溶液,它能使干燥的有色布条褪色 |
| C、实现HCl→Cl2的变化需要氧化剂才能实现 |
| D、氯水具有杀菌、漂白作用是因氯水中含有强氧化性的次氯酸 |
下列液体均处于25℃,有关叙述正确的是( )
| A、某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
| B、Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
| D、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
下列说法正确的是( )
| A、有气体参加的化学反应,若增大压强,可增加活化分子的百分数,从而使反应速率增大 |
| B、催化剂不参与反应,但能降低活化能增大活化分子的百分数,从而增大反应速率 |
| C、增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多 |
| D、升高温度能使化学反应速率增大,主要原因是增大了反应物分子中活化分子的百分数 |
下列有关四个常用电化学装置的叙述正确的是( )
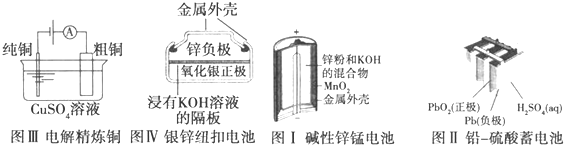

| A、图Ⅰ所示电池中,MnO2作催化剂 |
| B、图Ⅱ所示电池放电过程中,硫酸浓度不断增大 |
| C、图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变 |
| D、图Ⅳ所示电池中,Ag2O作氧化剂,在电池工作过程中被还原为Ag |
下列有关共价键的说法正确的是( )
| A、分子晶体中共价键越强,熔沸点越高 |
| B、只含共价键的物质,一定是共价化合物 |
| C、两种元素组成的分子中一定只含有极性共价键 |
| D、分子晶体中,可能不存在共价键,但一定存在分子间作用力 |