题目内容
5. 某固体燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )
某固体燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )| A. | 电池工作时,化学能主要转化为电能 | |
| B. | b极上的电极反应式为:O2+4H++4e-=2H2O | |
| C. | 每转移0.4mol电子,生成3.6g水 | |
| D. | H+由b极通过固体酸电解质传递到a极 |
分析 根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化还原反应,反应为H2-2e-═2H+,通入氧气的一极为电池的正极,发生氧化反应,反应为O2+4e-+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2,生成0.05mol水,据此进行解答.
解答 解:根据电池总反应:2H2+O2=2H2O可知:通入氢气的一极为电池的负极,发生氧化反应,反应为H2-2e-=2H+;通入氧气的一极为电池的正极,发生还原反应,反应为O2+4e-+4H+=2H2O;电池工作时,电子通过外电路从负极流向正极,即从a极流向b极,电解质中阳离子向正极移动,即H+由a极通过固体酸电解质传递到b极;每转移0.1mol电子,消耗0.05mol的H2,生成0.05mol水.
A.该装置为燃料电池,原电池工作时将化学能转化成电能,故A正确;
B.该电池为酸性电池,所以正极电极反应为:O2+4e-+4H+=2H2O,故B正确;
C.每转移0.4 mol电子,生成0.2mol水,质量为:0.2mol×18g/mol=3.6g,故C正确;
D.原电池中,阳离子向正极移动,所以H+由a极通过固体酸电解质传递到b极,故D错误;
故选D.
点评 本题考查原电池工作原理,高考中的常见题型,属于中等难度的试题,侧重考查学生灵活运用原电池原理解决实际问题的能力,学习中要明确原电池电子以及离子的定向移动问题,要能正确判断原电池的正负极,以及电极反应式的书写等问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.在一定条件下,不是可逆反应A(g)+3B(g)?2C(g)达到平衡标志的为( )
| A. | C生成速率与C分解速率相等 | B. | A、B、C的浓度不再变化 | ||
| C. | A、B、C的物质的量之比为1:3:2 | D. | 体系压强不再变化 |
16.如图物质一定属于同系物的是( )


| A. | ④和⑧ | B. | ①、②和③ | C. | ⑤、⑦和⑧ | D. | ④、⑥和⑧ |
13.元素X、Y可组成化学式为XY2的离子化合物,则X、Y的原子序数可能是( )
| A. | 12和8 | B. | 6和8 | C. | 12和17 | D. | 20和16 |
20.能得到硅酸的化学反应( )
| A. | 石英和浓盐酸混合 | B. | 水玻璃中通入二氧化碳 | ||
| C. | 硅藻土和浓烧碱共热 | D. | 二氧化硅和氢氟酸混合 |
10.下列关于物质的性质或用途的说法正确的是( )
| A. | 乙烯可使溴的四氯化碳溶液褪色 | B. | 乙醇难溶于水,密度比水小 | ||
| C. | 氧化镁用于电解冶炼单质镁 | D. | 二氧化硅用于制造太阳能电池 |
14.只用一种试剂,将分别含有 Fe3+、Al3+、Mg2+、NH4+等阳离子的四种溶液区分开,这种试剂是( )
| A. | NaOH 溶液 | B. | NaCl 溶液 | C. | KSCN 溶液 | D. | 氨水 |
15.“类比法”是化学学习中的一种常用方法.下列说法正确的是( )
| A. | CO2 能使漂白粉水溶液先变浑浊后变澄清,SO2 也有同样现象 | |
| B. | 加热条件下,Na与O2反应生成Na2O2,Li与O2反应也生成过氧化锂 | |
| C. | 常温下,浓硝酸能使铁、铝钝化,浓硫酸也能使铁、铝钝化 | |
| D. | 铁可置换出硫酸铜溶液中的铜,钠也可置换出硫酸铜溶液中的铜 |
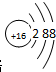 .
. .
. .
. .
. .
.