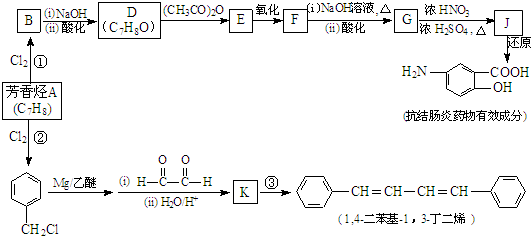
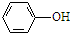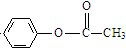题目内容
已知二氧化硫气体可使澄清石灰水变浑浊,也能使酸性高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2H2SO4
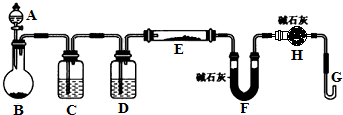
用图装置(还有一部分装置没画出)来验证某混合气体中同时含有SO2和CO2

①实验时,该混合气体应从 端通入; 从 端连接盛有澄清石灰水的实验装置(用“a”或“b”填空).
②预期能观察到A瓶溶液中的现象为 .
③C瓶溶液的作用是 .
④证明该混合气体中含有CO2的实验现象是 .
用图装置(还有一部分装置没画出)来验证某混合气体中同时含有SO2和CO2

①实验时,该混合气体应从
②预期能观察到A瓶溶液中的现象为
③C瓶溶液的作用是
④证明该混合气体中含有CO2的实验现象是
考点:探究二氧化硫与水和品红溶液的反应
专题:实验题
分析:①反应产物含有二氧化碳和二氧化硫气体,需要先验证二氧化硫的存在,除去二氧化硫,再验证二氧化碳气体的存在,气体通过溶液时导气管长进短出;
②A是验证二氧化硫气体的存在,二氧化硫能使品红溶液褪色;
③C瓶是检验SO2是否除尽,防止干扰二氧化碳的检验;
④当C装置品红不褪色,澄清石灰水变浑浊说明含有二氧化碳.
②A是验证二氧化硫气体的存在,二氧化硫能使品红溶液褪色;
③C瓶是检验SO2是否除尽,防止干扰二氧化碳的检验;
④当C装置品红不褪色,澄清石灰水变浑浊说明含有二氧化碳.
解答:
解:①反应产物含有二氧化碳和二氧化硫气体,都能使澄清石灰水变浑浊,需要先验证二氧化硫的存在,除去二氧化硫,再验证二氧化碳气体的存在,气体通过溶液导气管一个长进短出,所以实验时,反应产生的气体应从a端进入装置;检验二氧化硫并除去二氧化硫后,需要再用澄清石灰水检验二氧化碳,所以在b端再连接一个盛有澄清石灰水的实验装置,
故答案为:a;b;
②A是验证二氧化硫气体的存在,二氧化硫能使品红溶液褪色,所以A中的现象是品红溶液褪色,
故答案为:品红溶液褪色;
③C瓶是检验SO2是否除尽,防止干扰二氧化碳的检验,二氧化硫和二氧化碳均能使澄清石灰水变浑浊,所以检验二氧化碳以前应该先除去二氧化硫,
故答案为:检验SO2是否除尽;
④当C装置品红不褪色,证明二氧化硫气体除净,后面装置中的澄清石灰水变浑浊证明含有二氧化碳,
故答案为:C中品红不褪色,澄清石灰水变浑浊.
故答案为:a;b;
②A是验证二氧化硫气体的存在,二氧化硫能使品红溶液褪色,所以A中的现象是品红溶液褪色,
故答案为:品红溶液褪色;
③C瓶是检验SO2是否除尽,防止干扰二氧化碳的检验,二氧化硫和二氧化碳均能使澄清石灰水变浑浊,所以检验二氧化碳以前应该先除去二氧化硫,
故答案为:检验SO2是否除尽;
④当C装置品红不褪色,证明二氧化硫气体除净,后面装置中的澄清石灰水变浑浊证明含有二氧化碳,
故答案为:C中品红不褪色,澄清石灰水变浑浊.
点评:本题考查浓硫酸与碳反应气体产物的检验,题目难度中等.明确实验的原理和方法是解答该题的关键,侧重于酸性氧化物二氧化碳和二氧化硫的性质比较.

练习册系列答案
相关题目
(A 做)将100mL2.0mol/L的Na2SO4和300mL2.0mol/L的AI2(SO4)3的溶液混合,则混合溶液中SO42-的物质的量浓度约为(假设溶液的体积可以相加)( )
| A、6.0g/mol |
| B、5.0g/mol |
| C、10.0g/mol |
| D、4.0g/mol |
下列原子中未成对电子数为3的是( )
| A、O | B、N | C、F | D、Cu |
在密闭容器中充入CO2、CO、CH4的混合气体共mg,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增加mg;则CO2与CH4的体积比为( )
| A、3:1 | B、2:l |
| C、1:1 | D、缺少条件,无法计算 |
 某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,如图是测定装置的示意图.A中的试剂是盐酸.请回答下列问题:
某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,如图是测定装置的示意图.A中的试剂是盐酸.请回答下列问题:
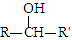 (R、R′表示烃基)
(R、R′表示烃基)