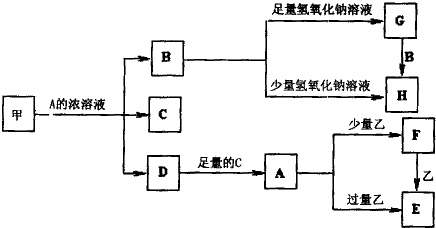
题目内容
某实验小组用0.55mol/L NaOH溶液和0.50mol/L盐酸溶液进行中和热的测定.
Ⅰ.配制0.55mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体 g.
Ⅱ.测定稀盐酸和稀氢氧化钠的中和热
(2)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒、0.5mol?L-1盐酸、0.55mol?L-1NaOH溶液,实验尚缺少的玻璃用是 、 .
他们记录的实验数据如下:
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18kJ?℃-1?kg-1,各物质的密度均为1g?cm-3.
(3)计算△H=
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响.
(5)某同学用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.慢慢把量筒中的氢氧化钠溶液倒入小烧杯
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
Ⅰ.配制0.55mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体
Ⅱ.测定稀盐酸和稀氢氧化钠的中和热
(2)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒、0.5mol?L-1盐酸、0.55mol?L-1NaOH溶液,实验尚缺少的玻璃用是
他们记录的实验数据如下:
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | △H | |||
| ① | 50mL0.55mol?L-1 NaOH溶液 | 50mL0.5mol?L-1 HCl溶液 | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol?L-1 NaOH溶液 | 50mL0.5mol?L-1 HCl溶液 | 20℃ | 23.5℃ | |
(3)计算△H=
(4)若用KOH代替NaOH,对测定结果
(5)某同学用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.慢慢把量筒中的氢氧化钠溶液倒入小烧杯
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
考点:中和热的测定
专题:实验题
分析:(1)根据公式m=nM=cVM来计算氢氧化钠的质量;
(2)根据各仪器的作用结合中和热实验原理来选取仪器;
(3)先根据Q=m?c?△T计算反应放出的热量,然后根据△H=-
kJ/mol计算出反应热.;
(4)中和热是稀的强酸和强碱反应生成1mol水放出的热量,只与反应有关,和量无关;
(5)根据实验的关键是保温,如果装置有能量散失,则会导致结果偏低,根据实验中用到的试剂以及实验操作知识来判断.
(2)根据各仪器的作用结合中和热实验原理来选取仪器;
(3)先根据Q=m?c?△T计算反应放出的热量,然后根据△H=-
| Q |
| n |
(4)中和热是稀的强酸和强碱反应生成1mol水放出的热量,只与反应有关,和量无关;
(5)根据实验的关键是保温,如果装置有能量散失,则会导致结果偏低,根据实验中用到的试剂以及实验操作知识来判断.
解答:
解:(1)应需250mL容量瓶,需要称量NaOH固体m=nM=cVM=0.55mol/L×0.25L×40g/mol=5.5g,故答案为:5.5;
(2)测定稀盐酸和稀氢氧化钠的中和热,所需要的玻璃仪器有:大、小两个烧杯、胶头滴管、量筒、温度计以及环形玻璃搅拌器,故答案为:温度计;环形玻璃搅拌器;
(3)根据Q=m?c?△T=4.18kJ?℃-1?kg-1×1000g/L×0.1L×
=1.42kJ,所以△H=-
kJ/mol=
=-56.8kJ/mol,故答案为:-56.8kJ/mol;
(4)若用KOH代替NaOH,都是一元强碱,对测定结果无影响;若用醋酸代替HCl做实验,由于醋酸是弱酸,电离是吸热的,所以导致放出的热量数值偏低,对测定结果有影响,故答案为:无;有;
(5)A.测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,所以导致实验测得中和热的数值偏小,故A正确;
B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失,实验测得中和热的数值偏小,故B正确;
C、做本实验的室温和反应热的数据之间无关,故C错误;
D、将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水,由于氨水是弱碱,碱的电离是吸热的过程,所以导致实验测得中和热的数值偏小,故D正确;
E、在量取盐酸时仰视计数,会使得实际量取体积高于所要量的体积,算过量,可以保证碱全反应,会使得中和和热的测定数据偏高,故E错误;
F、大烧杯的盖板中间小孔太大,会导致一部分能量散失,所以测的数值降低,故F正确.
故选ABDF.
(2)测定稀盐酸和稀氢氧化钠的中和热,所需要的玻璃仪器有:大、小两个烧杯、胶头滴管、量筒、温度计以及环形玻璃搅拌器,故答案为:温度计;环形玻璃搅拌器;
(3)根据Q=m?c?△T=4.18kJ?℃-1?kg-1×1000g/L×0.1L×
| 3.3℃+3.5℃ |
| 2 |
| Q |
| n |
| 1.42 |
| 0.05×0.5 |
(4)若用KOH代替NaOH,都是一元强碱,对测定结果无影响;若用醋酸代替HCl做实验,由于醋酸是弱酸,电离是吸热的,所以导致放出的热量数值偏低,对测定结果有影响,故答案为:无;有;
(5)A.测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,所以导致实验测得中和热的数值偏小,故A正确;
B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失,实验测得中和热的数值偏小,故B正确;
C、做本实验的室温和反应热的数据之间无关,故C错误;
D、将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水,由于氨水是弱碱,碱的电离是吸热的过程,所以导致实验测得中和热的数值偏小,故D正确;
E、在量取盐酸时仰视计数,会使得实际量取体积高于所要量的体积,算过量,可以保证碱全反应,会使得中和和热的测定数据偏高,故E错误;
F、大烧杯的盖板中间小孔太大,会导致一部分能量散失,所以测的数值降低,故F正确.
故选ABDF.
点评:本题综合考查了中和热的测定、误差分析,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
污水处理厂检测出一批污水中含有较多的重金属Ag+,欲将其除去,应加入适量的( )
| A、NaCl |
| B、BaSO4 |
| C、Al2O3 |
| D、HNO3 |
我国著名化工专家侯德榜先生提出的“侯氏制碱法”大大推进了纯碱工业的发展,他的贡献之一是( )
| A、找到了新型高效催化剂 |
| B、充分利用了能量 |
| C、提高了纯碱产品的纯度 |
| D、有效减少了环境污染 |
下列实验方案设计合理且能达到相应实验预期目的是( )
A、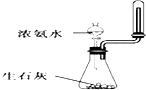 制取少量氨气 |
B、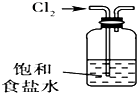 除去氯气中的HCl杂质 |
C、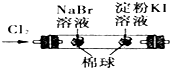 证明氧化性Cl2>Br2>I2 |
D、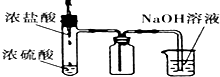 制取HCl且除去多余的气体 |
下列说法正确的是( )
| A、在任何条件下,纯水都呈中性 |
| B、pH<7的溶液一定呈酸性 |
| C、25℃时,纯水和稀酸溶液中水的离子积常数不相符 |
| D、pH均等于6的NH4Cl溶液和CH2COOH溶液中,水的电离程度相同 |
下列根据实验现象所得出的结论中,错误的是( )
| A、向无色溶液加入盐酸酸化的氯化钡溶液有白色沉淀,结论:溶液中含有SO42- |
| B、无色溶液焰色反应呈黄色,结论:溶液中含有Na+ |
| C、向无色试液加入硝酸酸化的硝酸银溶液产生白色沉淀,结论:溶液中含Cl-- |
| D、向某溶液中加入氢氧化钠溶液加热,有能使湿润的红色石蕊试纸变蓝的气体生成,结论:溶液中含有NH4+ |