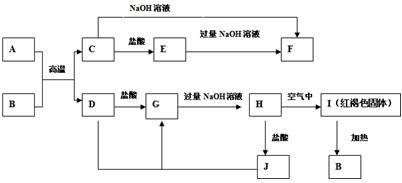
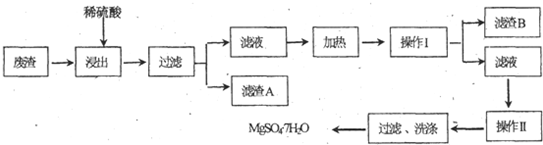
题目内容
将6.5g锌加入足量的稀硫酸中,当锌反应完全后,产生H2的体积在标准状况下为( )
| A、1.12L |
| B、2.24L |
| C、11.2L |
| D、22.4L |
考点:化学方程式的有关计算
专题:计算题
分析:硫酸足量,则锌完全反应,将锌的量代入化学反应方程式可计算氢气的体积.
解答:
解:令标准状况下生成氢气的体积为V,则:
Zn+H2SO4═ZnSO4+H2↑
65g 22.4L
6.5g V
所以6.5g:65g=V:22.4L,
解得V=2.24L,
故选B.
Zn+H2SO4═ZnSO4+H2↑
65g 22.4L
6.5g V
所以6.5g:65g=V:22.4L,
解得V=2.24L,
故选B.
点评:本题考查学生利用化学反应方程式的计算,比较基础,掌握根据方程式的计算.

练习册系列答案
相关题目
一定温度下,用水稀释c mol?L-1的稀醋酸,若用KW表示水的离子积,则下列数值随水量的增加而增大的是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列在水溶液中能大量共存的离子组是( )
| A、Fe3+、K+、CO32-、OH- |
| B、Ba2+、Na+、SO42-、NO3- |
| C、Na+、Ag+、HCO3-、Cl- |
| D、K+、NH4+、Br-、I- |
下面三个方法都可以用来制氯气:
①4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O
②4HCl(g)+O2
2Cl2+2H2O(g)
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
则三种氧化剂由强到弱的顺序是( )
①4HCl(浓)+MnO2
| ||
②4HCl(g)+O2
| ||
| △ |
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
则三种氧化剂由强到弱的顺序是( )
| A、O2MnO2KMnO4 |
| B、KMnO4MnO2O2 |
| C、MnO2KMnO4O2 |
| D、O2KMnO4MnO2 |