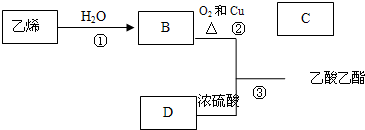
题目内容
A~J为中学化学中常见的物质,它们之间有如下转化关系.其中A、D为金属单质.(反应过程中生成的水和其它产物已略去)
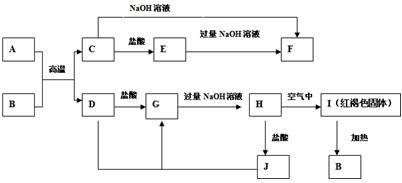
请回答以下问题:
(1)化学式:A ,B ,J
(2)H→I的化学反应方程式
(3)C→F离子反应方程式 .

请回答以下问题:
(1)化学式:A
(2)H→I的化学反应方程式
(3)C→F离子反应方程式
考点:无机物的推断
专题:推断题
分析:依据转化关系中的反应现象可知I为红褐色沉淀Fe(OH)3;H为Fe(OH)2,G为FeCl2,B为氢氧化铁分解生成的产物为Fe2O3,D为Fe,D和J反应生成FeCl2说明J为FeCl3,C和盐酸反应和氢氧化钠反应说明是两性化合物,判断AB反应发生的是铝热反应,C为Al2O3,A为 Al,E为AlCl3,F为NaAlO2,依据判断出物质分析回答;
解答:
解:依据转化关系中的反应现象可知I为红褐色沉淀Fe(OH)3;H为Fe(OH)2,G为FeCl2,B为氢氧化铁分解生成的产物为Fe2O3,D为Fe,D和J反应生成FeCl2说明J为FeCl3,C和盐酸反应和氢氧化钠反应说明是两性化合物,判断AB反应发生的是铝热反应,C为Al2O3,A为 Al,E为AlCl3,F为NaAlO2,
(1)依据分析推断可知,ABJ的化学式为:Al、Fe2O3、FeCl3,故答案为:Al、Fe2O3、FeCl3;
(2)H→I是氢氧化亚铁被氧气氧化为氢氧化铁的反应,反应的化学反应方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3 ;故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)C→F是Al2O3和氢氧化钠反应生成偏铝酸钠和水的反应,反应离子反应方程式为:Al2O3+2OH-=2AlO2-+H2O;
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(1)依据分析推断可知,ABJ的化学式为:Al、Fe2O3、FeCl3,故答案为:Al、Fe2O3、FeCl3;
(2)H→I是氢氧化亚铁被氧气氧化为氢氧化铁的反应,反应的化学反应方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3 ;故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)C→F是Al2O3和氢氧化钠反应生成偏铝酸钠和水的反应,反应离子反应方程式为:Al2O3+2OH-=2AlO2-+H2O;
故答案为:Al2O3+2OH-=2AlO2-+H2O;
点评:本题考查了物质转化关系的分析判断,物质性质的应用,反应现象的判断应用,主要考查铁铝及其化合物的性质应用,书写离子方程式和化学方程式熟练掌握的基础.

练习册系列答案
相关题目
下列溶液中氯离子浓度最大的是( )
| A、500mL1mol/L 的 NaCl 溶液 |
| B、500mL1mol/L 的 MgCl2溶液 |
| C、100mL3mol/L 的 NaCl 溶液 |
| D、600mL1mol/L 的 NaCl 溶液 |
举办“人文奥运”的一个重要体现就是禁止运动员服用兴奋剂.有一种兴奋剂的结构简式如图,下列有关该物质的说法正确的是( )


| A、该分子中所有碳原子可以稳定的共存在一个平面中 |
| B、遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 |
| C、1mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4mol、7mol |
| D、滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在双键 |
将6.5g锌加入足量的稀硫酸中,当锌反应完全后,产生H2的体积在标准状况下为( )
| A、1.12L |
| B、2.24L |
| C、11.2L |
| D、22.4L |
下列实验操作正确的是( )
A、 |
B、 |
C、 |
D、 |