题目内容
3.现有a、b、c、d四种金属,①a、b合金铸造的日用品暴露在潮湿空气中a先被腐蚀;②电解b、c的硫酸盐混合溶液,电极上金属c析出后再析出b;③d的硝酸盐溶液呈中性,四种金属活泼性由强到弱的顺序是( )| A. | d、a、b、c | B. | d、b、a、c | C. | a、b、c、d | D. | a、b、d、c |
分析 金属越活泼,与酸反应越剧烈,形成原电池时,较活泼金属易被腐蚀,电解时氧化性较强的离子先得电子,金属离子的氧化性越强,对应的金属单质越不活泼,d的硝酸盐溶液呈中性,说明为强酸强碱盐,以此解答该题.
解答 解:①a、b合金铸造的日用品暴露在潮湿空气中a先被腐蚀,说明a为负极,较活泼;
②电解b、c的硫酸盐混合溶液,电极上金属c析出后再析出b,说明c的离子氧化性较强,c的单质活泼性较弱;
③d的硝酸盐溶液呈中性,说明为强酸强碱盐,d为活泼金属,
则活泼性d>a>b>c,
故选A.
点评 本题考查金属活动性顺序强弱判断,侧重考查知识运用能力,明确原电池中正负极与金属活泼性的关系、金属之间的置换反应即可解答,题目难度不大.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
13.今有如下三个热化学方程式:
2H2(g)+O2(g)═2H2O(g) 放热Q1 kJ
2H2(g)+O2(g)═2H2O(l) 放热Q2 kJ
H2(g)+$\frac{1}{2}$O2(g)═H2O(g) 放热Q3kJ
其中Q1Q2Q3大小关系是( )
2H2(g)+O2(g)═2H2O(g) 放热Q1 kJ
2H2(g)+O2(g)═2H2O(l) 放热Q2 kJ
H2(g)+$\frac{1}{2}$O2(g)═H2O(g) 放热Q3kJ
其中Q1Q2Q3大小关系是( )
| A. | Q1=Q2=Q3 | B. | 2Q3=Q1<Q2 | C. | Q3<Q2<Q1 | D. | Q1<Q2<3Q3 |
18.乙醇分子中不同的化学键,如图:关于乙醇在各种反应中断裂键的说法不正确的是( )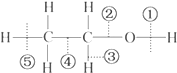

| A. | 乙醇和钠反应,键①断裂 | B. | 在铜催化下和O2反应,键①③断裂 | ||
| C. | 乙醇完全燃烧时键①②断裂 | D. | 与乙酸发生反应时,键①断裂 |
8.短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于 IA族,W与X属于同一主族.下列说法正确的是( )
| A. | 元素X、W的简单阴离子具有相同的电子层结构 | |
| B. | W的简单气态氢化物的热稳定性比Y的强 | |
| C. | 由Y、Z两种元素组成的化合物是离子化合物 | |
| D. | 原子半径:r(X)<r(Y)<r(Z)<r(W) |
15.实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程,Fe3+在pH=5时早已完全沉淀.其分析错误的是( )


| A. | 若要测定所得硫酸铜晶体中结晶水的数目,实验中要用到坩埚、坩埚钳和干燥器等 | |
| B. | 利用Cu(OH)2替代CuO也可调试溶液pH,不影响实验结果 | |
| C. | 洗涤晶体:向滤出晶体的漏斗中加少量冷水浸没晶体,自然流下,重复2-3次 | |
| D. | 用18.4mol/L浓硫酸配制溶解所用4.00mol/L的稀硫酸,玻璃仪器一般只有4种 |
16.下列说法不正确的是( )
| A. | 双键、三键中一定含有π键 | |
| B. | 成键原子间原子轨道重叠越多,共价键越牢固 | |
| C. | 因每个原子未成对电子数是一定的,故配对原子个数也一定 | |
| D. | 每一个原子轨道在空间都具有方向性 |

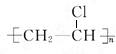 ,该反应类型是加聚反应
,该反应类型是加聚反应 下列每一方框中的字母代表一种反应物或生成物:
下列每一方框中的字母代表一种反应物或生成物: