题目内容
乙烯与液溴作用制取1,2--二溴乙烷的装置如图(D中试管里所装物质为液溴).1,2-二溴乙烷的主要物理性质是
填写下列空白:
(1)A是乙醇制备乙烯的反应装置图,B、D中所盛都是水,其中D装置中水的作用是: .
(2)C和E所盛都是NaOH溶液,它们的作用分别是:C ;E .
(3)分别写出装置A、D中发生反应的化学方程式:A ;D .

| 熔点 | 沸点 | 密度 | 溶解性 |
| 9.79℃ | 131.4℃ | 2.18g?cm-3 | 难溶于水,易溶于醇、醚等 |
(1)A是乙醇制备乙烯的反应装置图,B、D中所盛都是水,其中D装置中水的作用是:
(2)C和E所盛都是NaOH溶液,它们的作用分别是:C
(3)分别写出装置A、D中发生反应的化学方程式:A
考点:有机物的合成,乙烯的化学性质
专题:实验题,有机物的化学性质及推断
分析:(1)该反应为制取1,2-二溴乙烷,A是乙醇制备乙烯的反应装置图,由乙烯和溴发生加成反应生成1,2-二溴乙烷,溴易挥发,B、D中所盛都是水,其中D装置中水的作用是冷却液溴;
(2)浓硫酸具有强氧化性,能将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化硫和溴能反应,须用碱除去;溴易挥发,挥发到空气中会污染空气;
(3)A中的反应是乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,D中的反应是乙烯和溴加成生成1,2-二溴乙烷,据此解答.
(2)浓硫酸具有强氧化性,能将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化硫和溴能反应,须用碱除去;溴易挥发,挥发到空气中会污染空气;
(3)A中的反应是乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,D中的反应是乙烯和溴加成生成1,2-二溴乙烷,据此解答.
解答:
解:(1)A是乙醇制备乙烯的反应装置图,是利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,CH3CH2OH
CH2=CH2↑+H2O,浓硫酸具有强氧化性,能氧化乙醇,能将乙醇氧化成二氧化碳,自身被还原成二氧化硫,C所盛是NaOH溶液,吸收乙烯中混有的SO2、CO2,由乙烯和溴发生加成反应生成1,2-二溴乙烷,溴易挥发,B,所以D装置中水的作用是冷却液溴,冷却可避免溴的大量挥发,
故答案为:冷却液溴;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,SO2+2H2O+Br2=H2SO4+2HBr中S元素的化合价升高,二氧化硫被氧化,二氧化碳、二氧化硫能和氢氧化钠溶液反应,乙烯与氢氧化钠溶液不反应,溴易挥发,挥发到空气中会污染空气,常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,
故答案为:吸收乙烯中混有的SO2、CO2;吸收逸出的溴蒸气,防止污染空气;
(3)A中的反应是乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,反应方程式为CH3CH2OH
CH2=CH2↑+H2O,D中的反应是乙烯和溴加成生成1,2-二溴乙烷,反应方程式为CH2=CH2+Br2→CH2Br-CH2Br,
故答案为:CH3CH2OH
CH2=CH2↑+H2O;CH2=CH2+Br2→CH2Br-CH2Br.
| 浓硫酸 |
| △ |
故答案为:冷却液溴;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,SO2+2H2O+Br2=H2SO4+2HBr中S元素的化合价升高,二氧化硫被氧化,二氧化碳、二氧化硫能和氢氧化钠溶液反应,乙烯与氢氧化钠溶液不反应,溴易挥发,挥发到空气中会污染空气,常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,
故答案为:吸收乙烯中混有的SO2、CO2;吸收逸出的溴蒸气,防止污染空气;
(3)A中的反应是乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,反应方程式为CH3CH2OH
| 浓硫酸 |
| △ |
故答案为:CH3CH2OH
| 浓硫酸 |
| △ |
点评:本题主要考查了乙醇制备1,2-二溴乙烷,掌握相关物质的基本化学性质是解答本题的关键,平时须注意积累相关反应知识,题目不难.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
下列反应的离子方程式书写正确的是( )
| A、澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
| B、四氧化三铁溶于稀硝酸:Fe3O4+8H+=4H2O+Fe2++2Fe3+ |
| C、二氧化硅与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O |
| D、硅酸与烧碱溶液中和:H2SiO3+2OH-═SiO32-+2H2O |
关于下列装置说法正确的是( )


| A、装置①中,盐桥中的K+移向ZnSO4溶液 |
| B、滴有酚酞溶液的装置②在电解过程中,b极先变红 |
| C、可以用装置③在铁上镀铜,d极为铜 |
| D、装置④中发生铁的吸氧腐蚀 |
食品添加剂让食品变得丰富多彩,但应正确使用食品添加剂.做馒头的过程中不能添加的是( )
| A、增白剂 | B、蔗糖 |
| C、小苏打 | D、食盐 |
化合物丙由如下反应制得:C4H
O
C4H
C4H
Br.丙的结构简式不可能的是( )
10 甲 |
| 浓硫酸,△ |
| 或Al2O4,△ |
8 乙 |
| Br2 |
| 溶液CCl4 |
8 丙 |
| A、CH3CH2CHBrCH2Br |
| B、CH3CH(CH2Br)2 |
| C、CH3CHBrCHBrCH3 |
| D、(CH3)2CBrCH2Br |
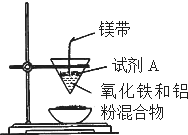 某小组进行铝热反应实验,装置如图所示.
某小组进行铝热反应实验,装置如图所示.