题目内容
现用如下实验装置测定铜和氧化铜混合物中铜元素的含量.
试回答下列问题:
(1)A中盛装盐酸的仪器名称为 .
(2)A中可观察到的现象为 .
(3)B装置的作用是 .
(4)在给D装置加热前,应该进行的一步操作是 ,其目的是: .
(5)已知D装置中铜和氧化铜混合物的质量为10g,经称量,反应前后E装置的质量分别为100.2g和102.0g,原混合物中铜元素的质量分数为 (假设各装置中的反应或吸收都是完全的).
(6)如不加F装置,会使实验结果 (填“偏低”或“偏高”).

试回答下列问题:
(1)A中盛装盐酸的仪器名称为
(2)A中可观察到的现象为
(3)B装置的作用是
(4)在给D装置加热前,应该进行的一步操作是
(5)已知D装置中铜和氧化铜混合物的质量为10g,经称量,反应前后E装置的质量分别为100.2g和102.0g,原混合物中铜元素的质量分数为
(6)如不加F装置,会使实验结果
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据常见仪器的名称进行解答;
(2)根据锌和盐酸生成氯化锌和氢气进行解答;
(3)根据盐酸具有挥发性以及氯化氢极易溶于水进行解答;
(4)根据氢气还原氧化铜的注意事项进行解答;
(5)根据E装置增加的质量为水的质量进行解答;
(6)根据如不加F装置会使得空气中水蒸气进入使得水的质量增加,那么计算出的氧化铜的质量也随着增加,所以会使实验结果偏小进行解答.
(2)根据锌和盐酸生成氯化锌和氢气进行解答;
(3)根据盐酸具有挥发性以及氯化氢极易溶于水进行解答;
(4)根据氢气还原氧化铜的注意事项进行解答;
(5)根据E装置增加的质量为水的质量进行解答;
(6)根据如不加F装置会使得空气中水蒸气进入使得水的质量增加,那么计算出的氧化铜的质量也随着增加,所以会使实验结果偏小进行解答.
解答:
解:(1)装有盐酸的仪器的名称为分液漏斗,故答案为:分液漏斗;
(2)锌和盐酸生成氯化锌和氢气,A中可观察到的现象为Zn粒逐渐减少,且有气泡产生,反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑,
故答案为:锌粒逐渐溶解且有气泡冒出;
(3)盐酸具有挥发性,挥发出氯化氢气体,所以B装置的作用是除去氢气中的HCl,故答案为:除去氢气中的氯化氢气体;
(4)氢气是可燃性气体,给D装置加热前,应该进行的一步操作是先通入H2;其目的是赶走管中的空气,防止加热时爆炸,
故答案为:先通入氢气,赶走玻璃管中的空气防止加热时爆炸;
(5)E装置增加的质量为水的质量,水的质量=102.0g-100.2g=1.8g
设参加反应的氧化铜的质量为x.
CuO+H2
Cu+H2O
80 18
x 1.8g
=
x=8.0g
氧化铜中铜元素的质量为:8.0g×
=6.4g
原混合物中铜元素的质量分数=
×100%=84%
原混合物中铜元素的质量分数为84%,
故答案为:84%;
(6)如不加F装置会使得空气中水蒸气进入使得水的质量增加,那么计算出的氧化铜的质量也随着增加,所以会使实验结果偏小,
故答案为:偏低.
(2)锌和盐酸生成氯化锌和氢气,A中可观察到的现象为Zn粒逐渐减少,且有气泡产生,反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑,
故答案为:锌粒逐渐溶解且有气泡冒出;
(3)盐酸具有挥发性,挥发出氯化氢气体,所以B装置的作用是除去氢气中的HCl,故答案为:除去氢气中的氯化氢气体;
(4)氢气是可燃性气体,给D装置加热前,应该进行的一步操作是先通入H2;其目的是赶走管中的空气,防止加热时爆炸,
故答案为:先通入氢气,赶走玻璃管中的空气防止加热时爆炸;
(5)E装置增加的质量为水的质量,水的质量=102.0g-100.2g=1.8g
设参加反应的氧化铜的质量为x.
CuO+H2
| ||
80 18
x 1.8g
| 80 |
| x |
| 18 |
| 1.8 |
x=8.0g
氧化铜中铜元素的质量为:8.0g×
| 64 |
| 64+16 |
原混合物中铜元素的质量分数=
| 10.0g-8.0g+6.4g |
| 10.0g |
原混合物中铜元素的质量分数为84%,
故答案为:84%;
(6)如不加F装置会使得空气中水蒸气进入使得水的质量增加,那么计算出的氧化铜的质量也随着增加,所以会使实验结果偏小,
故答案为:偏低.
点评:本题考查了实验探究物质性质的分析判断,该题是一道综合实验题,实验设计严密,考查的知识点较多,解题的关键是明确实验目的和原理,分析综合装置各部分的作用,题目难度中等.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
在水溶液中能够大量共存的是( )
| A、Na+、Cl-、NO3- |
| B、Ag+、Cl-、NO3- |
| C、NH4+、OH-、SO42- |
| D、Na+、Fe2+、OH- |
将下列物质按酸、碱、盐分类顺序排列正确的是( )
| A、硅酸 熟石灰 生石灰 |
| B、硫酸 烧碱 硫酸铝 |
| C、硝酸 小苏打 硫酸钾 |
| D、盐酸 纯碱 食盐 |
某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50mL b mol?L-1的硝酸溶液中,加热使其充分反应(假设硝酸只被还原成NO).下列说法正确的是( )
| A、若金属有剩余,在溶液中再滴入硫酸后,金属不再溶解 | ||
| B、若金属全部溶解后,再加入KSCN溶液,则溶液一定呈血红色 | ||
| C、若金属全部溶解,且产生336 mL气体(标准状况),则b=0.3 | ||
D、当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-
|
下列各组离子能在溶液中大量共存的是( )
A、HCO
| ||||
B、Al3+、K+、OH-、SO
| ||||
C、Fe3+、I-、SO
| ||||
D、K+、Al3+、SO
|
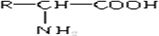 ,其分子中一定含有羧基(-COOH)和
,其分子中一定含有羧基(-COOH)和 是一种重要的合成材料,契单体的结构简式为
是一种重要的合成材料,契单体的结构简式为
 现有甲、乙、丙、丁4种物质,其转化关系如图:
现有甲、乙、丙、丁4种物质,其转化关系如图: )由两分子某链状有机物A反应得到,则与链状有机物A互为同分异构体且含有相同官能团的结构简式为
)由两分子某链状有机物A反应得到,则与链状有机物A互为同分异构体且含有相同官能团的结构简式为