题目内容
3.对有关NaClO和NaCl混合溶液的叙述正确的是( )| A. | 该溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,K+、OH-、S2-、NO3-能大量共存 | |
| C. | 向该溶液中滴入少量FeSO4溶液,离子方程式为:2Fe2++ClO-+2H+→Cl-+2Fe3++H2O | |
| D. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
分析 A.次氯酸钠具有强氧化性,能够氧化溴离子;次氯酸根离子与氢离子反应;
B.次氯酸钠能够氧化硫离子;
C.溶液中不存在氢离子,反应生成氢氧化铁沉淀;
D.根据反应ClO-+2H++Cl-=Cl2↑+H2O可知生成1mol氯气失去转移1mol电子.
解答 解:A.NaClO能够与H+、Br-发生反应,在溶液中不能大量共存,故A错误;
B.NaClO能够氧化S2-,在溶液中不能大量共存,故B错误;
C.向该溶液中滴入少量FeSO4溶液,次氯酸钠能够氧化亚铁离子,反应生成氢氧化铁沉淀,正确的离子方程式为:2Fe2++5ClO-+5H2O→Cl-+2Fe(OH)3↓+4HClO,故C错误;
D.发生反应为:ClO-+2H++Cl-=Cl2↑+H2O,生成1mol氯气转移了1mol电子,转移电子约为6.02×1023个,故D正确;
故选D.
点评 本题考查离子共存的判断、氧化还原反应的计算、离子方程式的书写等知识,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.下列有关元素周期律的叙述中,正确的是( )
| A. | 非金属性强弱:F2<Cl2 | B. | 金属性强弱:K<Na | ||
| C. | 酸性强弱:H2SO4<HClO4 | D. | 碱性强弱:NaOH<Mg(OH)2 |
11.现有8种元素的性质、数据如下表所列,它们属于第二或第三周期.
回答下列问题:
(1)③的元素符号是Li,⑧的元素名称是硼.
(2)在最高价氧化物的水化物中,酸性最强的化合物的名称是高氯酸.
碱性最强的化合物的电子式是: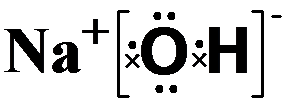 ,属离子化合物(填“离子”或“共价”).
,属离子化合物(填“离子”或“共价”).
(3)比较④和⑦的氢化物的稳定性(用分子式表示)NH3>PH3.
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)③的元素符号是Li,⑧的元素名称是硼.
(2)在最高价氧化物的水化物中,酸性最强的化合物的名称是高氯酸.
碱性最强的化合物的电子式是:
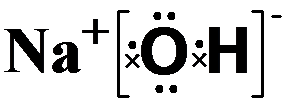 ,属离子化合物(填“离子”或“共价”).
,属离子化合物(填“离子”或“共价”).(3)比较④和⑦的氢化物的稳定性(用分子式表示)NH3>PH3.
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
18.向明矾溶液中逐滴加入Ba(OH)2溶液,当SO42-全部沉淀时,铝元素的主要存在形式为( )
| A. | AlO2- | B. | Al3+ | C. | Al(OH)3 | D. | Al(OH)3和Al3+ |
8.A、B、C、D、E、F、G为由七种短周期元素构成的粒子,它们都 有10个电子,其结构特点如下表:
其中,B的离子半径大于E的离子半径;D是由极性键构成的4原子分子;C常用作F的检验(加热).请填写下列空白:
(1)F粒子的电子式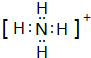 .
.
(2)比较BC和EC2的碱性强弱BC>EC2(填<、>、=).
(3)F与C加热时反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
| 粒子代号 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
(1)F粒子的电子式
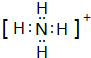 .
.(2)比较BC和EC2的碱性强弱BC>EC2(填<、>、=).
(3)F与C加热时反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
15.下列说法错误的是( )
| A. | 同浓度的下列溶液,c(NH4+)大小顺序:(NH4)2SO4>NH4HSO4>NH4Cl>NH4HCO3 | |
| B. | 同浓度的下列溶液,pH值大小顺序:Na2CO3>NaClO>NaHCO3>CH3COONa | |
| C. | 用水冲洗BaSO4比用稀硫酸冲洗损失大 | |
| D. | 用惰性电极电解某溶液,两极分别产生H2和O2,pH值一定升高 |
12.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol/L NaHCO3溶液,c(Na+)>c(OH-)>c(HCO3-)>c(H+) | |
| B. | 0.1mol/L K2S溶液中,c(K+)=c(S2-)+c(HS-)+c(H2S) | |
| C. | 常温时pH=2的盐酸和pH=12的氨水中由水电离出的c(H+)相等 | |
| D. | pH=3的盐酸和pH=11的氨水等体积混合完全反应后c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
13.下列废弃物,不可能直接回收利用的是( )
| A. | 易拉罐 | B. | 塑料拖鞋 | C. | 玻璃白酒瓶 | D. | 医用点滴管 |