题目内容
4.(1)配制100mL0.5mol•Lˉ1 Na2CO3溶液,需要称量无水Na2CO35.3g;(2)把4.48 升(标准状况下)HCl气体溶于水,配制成500mL的溶液,则:该溶液中HCl的物质的量浓度为0.4mol/L.
分析 (1)根据n=cV计算出碳酸钠的物质的量,然后根据m=nM计算出碳酸钠的质量;
(2)根据n=$\frac{V}{{V}_{m}}$计算出氯化氢的物质的量,然后根据c=$\frac{n}{V}$计算出所得溶液的浓度.
解答 解:(1)配制100mL0.5mol•L-1 Na2CO3溶液,需要碳酸钠的物质的量为:0.5mol/L×0.1L=0.05mol,需要碳酸钠的质量为:106g/mol×0.05mol=5.3g,
故答案为:5.3;
(2)标准状况下4.48LHCl的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,配制的溶液浓度为:$\frac{0.2mol}{0.5L}$=0.4mol/L,
故答案为:0.4 mol•L-1.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量与物质的量浓度、摩尔质量、气体摩尔体积等之间的关系为解答关键,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
14.在Na2O2与CO2的反应中,被氧化元素与被还原元素的质量比是( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 8:53 |
12.常温下,将0.1mol•L-1氢氧化钠溶液与0.06mol•L-1硫酸溶液等体积混合,该混合溶液的pH等于( )lg2=0.3.
| A. | 1.7 | B. | 2.0 | C. | 12.0 | D. | 11.7 |
9.在蒸发发皿中加热蒸干并灼烧(低于400℃)下列的溶液,可以得到该物质的固体是( )
| A. | 氯化铝溶液 | B. | 硫酸亚铁溶液 | C. | 碳酸氢钠溶液 | D. | 硫酸铝溶液 |
16.取三个干燥的烧瓶,分别装入标准状况下的干燥氨气、含有二分之一体积空气的氯化氢、二氧化氮和氧气(体积比为4:1)的混合气体;然后分别做溶解于水的喷泉实验.实验结束后三个烧瓶中所得溶液的物质的量浓度之比为( )
| A. | 2:1:2 | B. | 5:5:4 | C. | 1:1:1 | D. | 无法确定 |
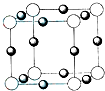 X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,U原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.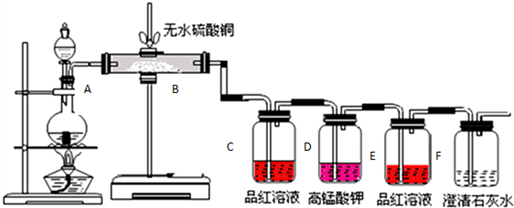

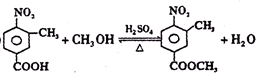 .
.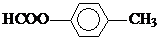 .
.