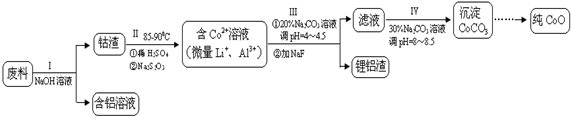
题目内容
有A、B、C、D四种元素,它们的原子序数依次增大,由B、C、D形成的离子具有相同的电子层结构.C、D单质都能跟水剧烈反应,1molC单质跟水反应产生11.2L(标准状况下)B气体单质,1molD单质跟水反应产生11.2L(标准状况下)A气体单质,此时D转化成具有氖原子核外电子层结构的离子.试填空:
(1)这两种元素的名称为A ,C .
(2)写出A2B的电子式 ,D离子的结构示意图 .
(3)这四种元素的原子半径由小到大的顺序为 (用元素符号来表示).
(4)写出C、D单质分别与水反应的化学方程式:C+H2O: ;D+H2O: .
(5)从以上两个反应中,判断B和C单质的氧化性: > ,A和D单质的还原性: > (均填化学式).
(1)这两种元素的名称为A
(2)写出A2B的电子式
(3)这四种元素的原子半径由小到大的顺序为
(4)写出C、D单质分别与水反应的化学方程式:C+H2O:
(5)从以上两个反应中,判断B和C单质的氧化性:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D四种元素,它们的原子序数依次增大,1molD单质跟水反应产生11.2L(标准状况下)A气体单质,此时D转化成具有氖原子核外电子层结构的离子,则D为钠元素,A为氢元素,由B、C、D形成的离子具有相同的电子层结构.C、D单质都能跟水剧烈反应,1molC单质跟水反应产生11.2L(标准状况下)B气体单质,则B为氧元素,C为氟元素,据此答题.
解答:
解:A、B、C、D四种元素,它们的原子序数依次增大,1molD单质跟水反应产生11.2L(标准状况下)A气体单质,此时D转化成具有氖原子核外电子层结构的离子,则D为钠元素,A为氢元素,由B、C、D形成的离子具有相同的电子层结构.C、D单质都能跟水剧烈反应,1molC单质跟水反应产生11.2L(标准状况下)B气体单质,则B为氧元素,C为氟元素,
(1)由上面的分析可知,A为氢,C为氟,
故答案为:氢;氟;
(2)A2B为水,它的电子式为 ,钠离子的结构示意图为
,钠离子的结构示意图为 ,
,
故答案为: ;
; ;
;
(3)电子层数越多,原子半径越大,电子层数相同时,核电荷数越小,原子半径越大,所以H、O、F、Na四种元素的原子半径由小到大的顺序为H<F<O<Na,
故答案为:H<F<O<Na;
(4)写出F2、Na单质分别与水反应的化学方程式为:2F2+2H2O=4HF+O2;2Na+2H2O=2NaOH+H2↑,
故答案为:2F2+2H2O=4HF+O2;2Na+2H2O=2NaOH+H2↑;
(5)从以上两个反应中,根据氧化剂的氧化性强于氧化产物,还原剂的还原性强于还原产物,可知F2和O2的氧化性:F2>O2,H2和Na的还原性:Na>H2,
故答案为:F2 ,O2,Na,H2.
(1)由上面的分析可知,A为氢,C为氟,
故答案为:氢;氟;
(2)A2B为水,它的电子式为
 ,钠离子的结构示意图为
,钠离子的结构示意图为 ,
,故答案为:
 ;
; ;
;(3)电子层数越多,原子半径越大,电子层数相同时,核电荷数越小,原子半径越大,所以H、O、F、Na四种元素的原子半径由小到大的顺序为H<F<O<Na,
故答案为:H<F<O<Na;
(4)写出F2、Na单质分别与水反应的化学方程式为:2F2+2H2O=4HF+O2;2Na+2H2O=2NaOH+H2↑,
故答案为:2F2+2H2O=4HF+O2;2Na+2H2O=2NaOH+H2↑;
(5)从以上两个反应中,根据氧化剂的氧化性强于氧化产物,还原剂的还原性强于还原产物,可知F2和O2的氧化性:F2>O2,H2和Na的还原性:Na>H2,
故答案为:F2 ,O2,Na,H2.
点评:本题主要考查了电子式、离子结构示意图、元素周期律、化学方程式、氧化还原性的比较等知识点,中等难度,解题的关键在于元素推断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列表示水解的离子方程式正确的是( )
| A、CH3COO-+H2O?CH3COOH+OH- |
| B、NH4++H2O?NH4OH+H+ |
| C、S2-+2H2O?H2S+2OH- |
| D、HCO3-+H2O?H3O++CO32- |
下列指定反应的离子方程式正确的是( )
| A、Cu溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O |
| B、向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| C、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ |
| D、用CuCl2溶液做导电性实验,灯泡发光:CuCl2=Cu2++2Cl- |
 一密闭容器中发生下列反应:N2(g)+3H2(g)?2NH3(g);△H<0
一密闭容器中发生下列反应:N2(g)+3H2(g)?2NH3(g);△H<0