题目内容
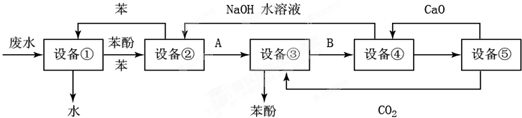
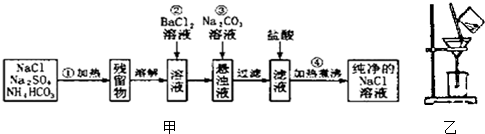
实验室里需要纯净的氯化钠固体,现有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如甲方案:
回答下列问题:
(1)操作②能否改为加硝酸钡溶液 .
(2)进行操作②后,如何判断SO
已除尽,方法是 .
(3)操作③的目的是 ,为什么不先过滤后加碳酸钠溶液 ;若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是 .
(4)如图乙所示,过滤操作中的一处错误是 .
(5)该实验方案缺少的最后一步操作的是 .

回答下列问题:
(1)操作②能否改为加硝酸钡溶液
(2)进行操作②后,如何判断SO
2- 4 |
(3)操作③的目的是
(4)如图乙所示,过滤操作中的一处错误是
(5)该实验方案缺少的最后一步操作的是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:混有硫酸钠、碳酸氢铵的氯化钠,加热除去碳酸氢铵,得到残留物溶解后加入氯化钡溶液沉淀硫酸根离子,加入碳酸钠沉淀过量的钡离子,过滤后加入盐酸除去过量碳酸钠,加热蒸发结晶得到氯化钠晶体;
(1)除杂时不能引入新的杂质;
(2)加入氯化钡溶液检验硫酸根离子是否除尽;
(3)加入碳酸钠溶液,除去过量的氯化钡溶液中钡离子;不过滤加入碳酸钠最后一次过滤沉淀,减少实验操作;若先加入盐酸生成的沉淀会部分溶解;
(4)依据过滤实验基本操作和方法分析装置操作的问题;
(5)纯净的氯化钠溶液得到晶体是蒸发结晶得到氯化钠晶体.
(1)除杂时不能引入新的杂质;
(2)加入氯化钡溶液检验硫酸根离子是否除尽;
(3)加入碳酸钠溶液,除去过量的氯化钡溶液中钡离子;不过滤加入碳酸钠最后一次过滤沉淀,减少实验操作;若先加入盐酸生成的沉淀会部分溶解;
(4)依据过滤实验基本操作和方法分析装置操作的问题;
(5)纯净的氯化钠溶液得到晶体是蒸发结晶得到氯化钠晶体.
解答:
解:(1)加入硝酸钠溶液,硝酸钠和硫酸钠反应生成硫酸钡和硝酸钠,除去了硫酸钠,但引入了硝酸钠等新的杂质,以后操作中无法除去;
故答案为:不能,用硝酸钡会引入新杂质NO3-,以后操作中无法除去;
(2)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽,
故答案为:取少量上层澄清溶液,再滴加BaCl2溶液,如无沉淀出现则说明SO42-已除尽,反之则有;
(3)操作③加入碳酸钠溶液,碳酸钠与过量的氯化钠反应生成碳酸钡和氯化钠,除去过量的氯化钡,再过滤;先过滤而后加碳酸钠溶液,在加入碳酸钠溶液后生成的碳酸钡还需要过滤,若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是若先加入盐酸生成的沉淀会部分溶解;
故答案为:除去过量的Ba2+;减少一次过滤操作;在酸性条件下会有部分沉淀溶解;
(4)依据过滤实验基本操作和方法分析可知装置中操作的错误是漏斗下方未紧靠烧杯内壁;
故答案为:漏斗下方未紧靠烧杯内壁;
(5)实验室里需要纯净的氯化钠固体,得到氯化钠溶液得到晶体是蒸发结晶得到,故答案为:蒸发结晶.
故答案为:不能,用硝酸钡会引入新杂质NO3-,以后操作中无法除去;
(2)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽,
故答案为:取少量上层澄清溶液,再滴加BaCl2溶液,如无沉淀出现则说明SO42-已除尽,反之则有;
(3)操作③加入碳酸钠溶液,碳酸钠与过量的氯化钠反应生成碳酸钡和氯化钠,除去过量的氯化钡,再过滤;先过滤而后加碳酸钠溶液,在加入碳酸钠溶液后生成的碳酸钡还需要过滤,若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是若先加入盐酸生成的沉淀会部分溶解;
故答案为:除去过量的Ba2+;减少一次过滤操作;在酸性条件下会有部分沉淀溶解;
(4)依据过滤实验基本操作和方法分析可知装置中操作的错误是漏斗下方未紧靠烧杯内壁;
故答案为:漏斗下方未紧靠烧杯内壁;
(5)实验室里需要纯净的氯化钠固体,得到氯化钠溶液得到晶体是蒸发结晶得到,故答案为:蒸发结晶.
点评:常见物质的分离方法和提纯是现在考试的重点和热点,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
以下实验操作或方法不正确的是( )
A、 闻气体的气味 |
B、 用浓硫酸 |
C、 向容量瓶中转移液体 |
D、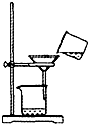 过滤 |
下列说法正确的是( )
| A、凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物 |
| B、两种化合物组成元素相同,各元素质量分数也相同,则两者一定是同分异构体 |
| C、油脂、淀粉、纤维素、蛋白质都是高分子化合物、 |
| D、医院用紫外线灯消毒的依据的原理是紫外线能使病毒蛋白质发生变性 |
用括号内的试剂除去下列各组物质中含有的少量杂质,正确的是( )
| A、溴苯中的溴(NaOH溶液,分液) |
| B、乙酸乙酯中的乙醇(乙酸,分液) |
| C、苯中的苯酚(浓溴水,过滤) |
| D、乙醇中的乙酸(饱和Na2CO3溶液,分液) |