题目内容
12.做实验时不小心使皮肤上沾了一些高锰酸钾,形成的黑斑很久才能消除,如果用草酸(乙二酸)的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为:MnO4-+H2C2O4+H+═CO2↑+Mn2++□下列有关叙述不正确的是(?)| A. | 该反应的氧化剂为KMnO4 | |
| B. | 发生还原反应的是H2C2O4 | |
| C. | 该离子方程式右侧方框内的产物是H2O | |
| D. | 6mol H+参加反应时,电子转移10mol |
分析 MnO4-+H2C2O4+H+═CO2↑+Mn2++□中,Mn元素的化合价降低,C元素的化合价升高,由电子守恒、电荷守恒可知2MnO4-+5H2C2O42-+6H+═10CO2↑+2Mn2++□,由原子守恒可知□为水,以此来解答.
解答 解:A.Mn元素的化合价降低,则KMnO4为氧化剂,故A正确;
B.C元素的化合价升高,失去电子,则H2C2O4发生氧化反应,故B错误;
C.由电子、电荷及原子守恒可知,离子反应为2MnO4-+5H2C2O42-+6H+═10CO2↑+2Mn2++8H2O,则方框内的产物是H2O,故C正确;
D.6mol H+参加反应时,2molMn得到电子,则电子转移为2mol×(7-2)=10mol,故D正确;
故选B.
点评 本题考查氧化还原反应,把握反应中元素化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意元素化合价的判断,题目难度不大.

练习册系列答案
相关题目
2.用石英砂和焦炭在高温下可以获得粗硅,其反应方程式如下:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO.下列有关该反应的说法正确的是( )
| A. | SiO2是还原剂 | B. | C被氧化 | ||
| C. | SiO2发生氧化反应 | D. | O得到电子 |
3.能用CO32-+2H+═H2O+CO2↑离子方程式表示的反应是( )
| A. | (NH4)2CO3+H2SO4═(NH4)2SO4+H2O+CO2↑ | |
| B. | NaHCO3+HNO3═NaNO3+H2O+CO2↑ | |
| C. | Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑ | |
| D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
2.下列微粒的物质的量浓度关系正确的是( )
| A. | pH=4的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| B. | 物质的量浓度相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液中,c(NH4+)大小顺序为:③>②>① | |
| C. | 等体积,等物质的量浓度的Na2S溶液与NaHS溶液混合后:3c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) | |
| D. | 等体积、等物质的量浓度的Na2SO3溶液与HCl溶液混合后:c(H+)+c(H2SO3)═c(SO32-)++c(OH-) |
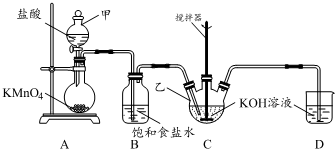 实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.
实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.