题目内容
1.下列表示对应化学反应的离子方程式正确的是( )| A. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 用惰性电极电解CuSO4溶液:2Cu2++2H2O═4H++O2↑+2Cu | |
| D. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O |
分析 A.酸性溶液中不生成氢氧根离子;
B.漏写碳酸氢根离子与碱反应;
C.生成Cu、氧气和硫酸;
D.电子、电荷不守恒.
解答 解:A.用KIO3氧化酸性溶液中的KI的离子反应为5I-+IO3-+6H+═3I2+3H2O,故A错误;
B.向NH4HCO3溶液中加过量的NaOH溶液并加热的离子反应为HCO3-+NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+CO32-,故B错误;
C.用惰性电极电解CuSO4溶液的离子反应为2Cu2++2H2O═4H++O2↑+2Cu,故C正确;
D.Cu溶于稀硝酸HNO3的离子反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故D错误;
故选C.
点评 本题考查离子方程式正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、水解反应的离子反应考查,注意离子反应中保留化学式的物质及电荷、电子守恒,题目难度不大.

练习册系列答案
相关题目
11.阿司匹林的结构简式为 ,关于阿司匹林的叙述正确的是( )
,关于阿司匹林的叙述正确的是( )
 ,关于阿司匹林的叙述正确的是( )
,关于阿司匹林的叙述正确的是( )| A. | 阿司匹林属于抗生素 | |
| B. | 阿司匹林不能发生水解反应 | |
| C. | 阿司匹林具有解热镇痛作用 | |
| D. | 阿司匹林之所以成为经典药物是因为服用该药物没有不良反应 |
12.下列叙述中正确的是( )
| A. | 非金属氧化物都是酸性氧化物 | |
| B. | CaCO3是电解质,但CaCO3的水溶液几乎不导电 | |
| C. | 金属Al是非电解质,但金属Al能导电 | |
| D. | H2SO4(纯)是电解质,因此H2SO4(纯)能导电 |
9.下列叙述正确的是( )
| A. | NaCl的摩尔质量是58.5 g | |
| B. | 含1 mol NaCl的溶液中约含有6.02×1023个Cl- | |
| C. | 1 mol NaCl的质量是58.5 g•mol-1 | |
| D. | 58.5 g NaCl所含Na+和Cl-共1mol |
16. 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成
甲醇:2H2(g)+CO(g)?CH3OH(g)
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的△H<0(填“>”、“<”或“=”).
②300℃时,将容器的容积压缩到原来的$\frac{1}{2}$,在其他条件不变的情况下,对平衡体系产生的影响是CD(填字母).
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡时$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为250℃,以CH3OH表示该过程的反应速率v(CH3OH)=0.08mol/(L.min).
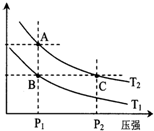
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A< C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②300℃时,将容器的容积压缩到原来的$\frac{1}{2}$,在其他条件不变的情况下,对平衡体系产生的影响是CD(填字母).
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡时$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为250℃,以CH3OH表示该过程的反应速率v(CH3OH)=0.08mol/(L.min).
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A< C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
13.下列各组物质中化学键的类型相同的是( )
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2O | D. | NH3 H2O CO2 |
15.近几年来,我国多次出现大范围雾霾天气,许多城市发布PM2.5重度污染警报.下列行为能缓解城市大气中PM2.5浓度的是( )
| A. | 燃放烟花爆竹 | B. | 为城市主干道洒水保洁 | ||
| C. | 大面积开发土建项目 |