题目内容
下列离子方程式中,正确的是( )
| A、铁跟稀H2SO4反应:2Fe+6H+=2Fe3++3H2↑ |
| B、碳酸钙溶于稀盐酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、铜与硝酸银溶液反应:Cu+Ag+=Cu2++Ag |
| D、氢氧化钡溶液与稀H2SO4 反应:Ba2++SO42-=BaSO4↓ |
考点:离子方程式的书写
专题:离子反应专题
分析:A、稀硫酸是弱氧化剂,只能将铁氧化为亚铁;
B、碳酸钙不溶于水,离子方程式中应写成化学式;
C、电子得失不守恒;
D、漏掉一组离子反应.
B、碳酸钙不溶于水,离子方程式中应写成化学式;
C、电子得失不守恒;
D、漏掉一组离子反应.
解答:
解:A、稀硫酸是弱氧化剂,只能将铁氧化为亚铁,正确的离子方程式为Fe+2H+=Fe2++H2↑,故A错误;
B、碳酸钙不溶于水,离子方程式中应写成化学式,正确的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑,故B正确;
C、电子得失不守恒,离子方程式为Cu+2Ag+=Cu2++2Ag,故C错误;
D、漏掉一组离子反应,正确的离子方程式为2H++SO42-+Ba2++2OH-═2H2O+BaSO4↓,故D错误;
故选B.
B、碳酸钙不溶于水,离子方程式中应写成化学式,正确的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑,故B正确;
C、电子得失不守恒,离子方程式为Cu+2Ag+=Cu2++2Ag,故C错误;
D、漏掉一组离子反应,正确的离子方程式为2H++SO42-+Ba2++2OH-═2H2O+BaSO4↓,故D错误;
故选B.
点评:本题考查离子方程式的书写,题目难度不大,注意从化学式、离子符号、电荷守恒以及是否符合反应实际的角度分析.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
下列说法中正确的是( )
| A、1L 水中溶解了58.5g NaCl,该溶液的物质的量浓度为1mol/L |
| B、从1L 2mol/L的H2SO4溶液中取出0.5L,该溶液的浓度为1mol/L |
| C、配制500mL 0.2mol/L的CuSO4溶液,需25g胆矾 |
| D、中和100mL 1mol/L的H2SO4溶液,需NaOH 4g |
当光束通过下列分散系时,能产生“丁达尔效应”的是( )
| A、稀硫酸 | B、硫酸铜溶液 |
| C、饱和食盐水 | D、氢氧化铝胶体 |
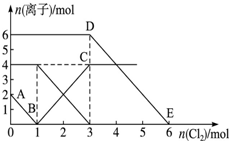 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:Cl2+2Br-═2Cl-+Br2,2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.则下列说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:Cl2+2Br-═2Cl-+Br2,2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.则下列说法中不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、原混合溶液中FeBr2的物质的量为3mol |
| C、线段AB表示Fe2+被氯气氧化 |
| D、原溶液中:n(Fe2+):n(I-):n(Br-)═2:1:3 |
2013年2月朝鲜进行了第三次核试验,引起国际社会的极大关注.235 92U是一种重要的核燃料,
U和
U的关系是( )
235 92 |
238 92 |
| A、中子数相同 |
| B、同种原子 |
| C、同位素 |
| D、同种核素 高温 |
用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )
| A、SO2、CS2、HI都是直线形的分子 |
| B、BF3键角为120°,SnBr2键角大于120° |
| C、COCl2、BF3、SO3都是平面三角形的分子 |
| D、PCl3、NH3、PCl5都是三角锥形的分子 |
称量烧碱时,烧碱必须( )
| A、直接放在托盘上 |
| B、放在滤纸上 |
| C、放在烧杯上 |
| D、放在称量纸上 |
下列有关CuSO4?5H2O的叙述正确的是( )
| A、1mol CuSO4?5H2O的质量为250g/mol |
| B、CuSO4?5H2O的摩尔质量为250g |
| C、CuSO4?5H2O的摩尔质量为250g/mol |
| D、配制100mL 0.1mol/L 硫酸铜溶液需要CuSO4?5H2O 1.6g |