题目内容
8.下列说法正确的是( )| A. | 某温度下纯水PH=6,则在该条件下PH=4的醋酸和PH=10的NaOH中水的电离程度相同 | |
| B. | NH4Cl溶于D2O的离子方程式:NH4+D2O?NH3•D2O+H+ | |
| C. | 已知S燃烧热为QKJ/mol,则S(s)+$\frac{3}{2}$O2(g)═SO3(g);△H=-QKJ/mol | |
| D. | 水的自偶电离方程式:2H2O?H3O-+OH-,则液氨自偶电离:2NH3?NH4++NH2- |
分析 A.某温度下纯水PH=6,Kw=10-12,计算醋酸溶液中氢离子浓度和氢氧化钠溶液中氢氧根离子浓度判断对水电离的影响;
B.铵根离子水解结合水中氢氧根离子形成一水合氨和氢离子,依据过程分析判断;
C.硫燃烧只能生成二氧化硫;
D.水的电离方程式书写液氨的自偶电离方程式;
解答 解:A.某温度下纯水PH=6,Kw=10-12,在该条件下PH=4的醋酸溶液中氢离子浓度10-4mol/L,PH=10的NaOH中氢氧根离子浓度=$\frac{1{0}^{-12}}{1{0}^{-10}}$=0.01mol/L,醋酸溶液中水电离程度大,水的电离程度不相同,故A错误;
B.NH4Cl溶于D2O中的反应离子方程式为:NH4++D2O?NH3•DHO+D+,故B错误;
C.硫燃烧只能生成二氧化硫,已知S燃烧热为QKJ/mol,则S(s)+O2(g)═SO2(g);△H=-QKJ/mol,故C错误;
D.水电离生成H3O+和OH-叫做水的自偶电离.同水一样,液氨也有自偶电离,其自偶电离的方程式为:NH3+NH3?NH4++NH2-,故D正确;
故选D.
点评 本题考查了影响谁电离平衡的因素、盐类水解、燃烧热概念和电离过程的分析判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
18.下列化学用语中正确的是( )
| A. | ${\;}_{8}^{18}$O2-离子结构示意图: | B. | HClO的结构式:H-O-Cl | ||
| C. | NF3的比例模型: | D. | H2O2的电子式: |
3.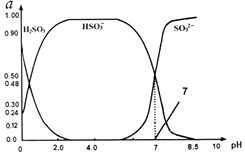 常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )
常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )
 常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )
常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )| A. | 由图中数据可计算得到常温下亚硫酸溶液的Ka2 | |
| B. | 在0.1mol•L-1H2SO3溶液中,存在:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw | |
| C. | 向pH为7的溶液中滴入少量稀盐酸造成的溶液pH变化小于向pH为4.0的溶液中滴入相同量稀盐酸造成的溶液pH变化 | |
| D. | 在pH=2.0溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-) |
20.将0.01mol的NaHCO3加入0.1mol•L-1、50mLH2SO4溶液中,充分反应后向混合液中加入1.31g的BaCl2•xH2O,Ba2+完全沉淀,则x的值不可能是( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
17.原子序数依次增大的4种元素a、b、c、d,它们的原子L层电子数分别为5、6、8、8.C+的电子层结构与Ne的电子层结构相同,d-与c+多1个电子层.下列叙述正确的是( )
| A. | 元素的非金属性a>b | |
| B. | a与b只能形成两种化合物:ab和ab2 | |
| C. | c和其他3种元素均能形成离子化合物 | |
| D. | d与a元素能形成离子化合物 |