题目内容
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入6mol?L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A、60 mL |
| B、50 mL |
| C、30 mL |
| D、15 mL |
考点:化学方程式的有关计算
专题:计算题
分析:向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,由电荷守恒可知,Cu提供电子物质的量等于氢氧化铜中氢氧根的物质的量,生成NO2、NO的混合气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,纵观整个过程,由电子转移守恒,可知Cu提供电子等于氧气获得的电子,据此计算n(NaOH),进而计算消耗氢氧化钠溶液体积.
解答:
解:生成NO2、N2O4、NO的混合气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,纵观整个过程,由电子转移守恒,可知Cu提供电子等于氧气获得的电子,即Cu提供电子为
×4=0.15mol,
向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,由电荷守恒可知,Cu提供电子物质的量等于氢氧化铜中氢氧根的物质的量,故n(NaOH)=0.15mol×2=0.3mol,故消耗氢氧化钠溶液体积为
=0.05L=50mL,
故选B.
| 1.68L |
| 22.4L/mol |
向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,由电荷守恒可知,Cu提供电子物质的量等于氢氧化铜中氢氧根的物质的量,故n(NaOH)=0.15mol×2=0.3mol,故消耗氢氧化钠溶液体积为
| 0.3mol |
| 6mol/L |
故选B.
点评:本题考查氧化还原反应的计算,为高频考点,整体把握反应中电子守恒及物质的量浓度的计算等为解答的关键,侧重考查学生的分析思维能力与解题方法技巧,题目难度中等.

练习册系列答案
相关题目
关于SO2的说法中不正确的是( )
| A、SO2能漂白某些物质,说明它具有氧化性 |
| B、SO2的水溶液能使紫色石蕊溶液变红,说明它能与水反应生成亚硫酸 |
| C、将足量的SO2通入酸性高锰酸钾溶液中,溶液褪色,说明它具有还原性 |
| D、实验室可以用氢氧化钠溶液处理含有SO2的尾气 |
下列化学用语正确的是( )
A、聚丙烯的结构简式: |
B、2-甲基-1-丁烯分子的键线式: |
C、四氯化碳分子的电子式: |
D、丙烷分子的比例模型: |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )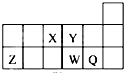

| A、元素X与元素Z的最高正化合价之和的数值等于7 |
| B、原子半径的大小顺序为:rZ>rW>rQ>rY>rX |
| C、离子Y2-和Z3+的核外电子数、电子层数和质子数都相同 |
| D、元素W的最高价氧化物对应的水化物的酸性比Q的弱 |
能正确表示下列化学反应的离子方程式的是( )
| A、稀硝酸与锌的反应:2H++Zn=H2↑+Zn2+ |
| B、二氧化氮通入水中:3NO2+H2O=2H++2NO3-+NO |
| C、过氧化钠和水反应:Na2O2+H2O=2Na++2OH-+O2↑ |
| D、二氧化碳通入过量澄清石灰水中:CO2+OH-=HCO3- |
下列物质不属于有机物的是( )
| A、C2H6O |
| B、C2H4O2 |
| C、C6H6O |
| D、KSCN |
糖类、油脂、蛋白质是人类基本营养物质,关于糖类、油脂、蛋白质的说法错误的是( )
| A、单糖都可以发生银镜反应 |
| B、氨基酸、多肽、蛋白质都具有两性 |
| C、油脂皂化是取代反应,硬化是加成反应 |
| D、淀粉、纤维素、蛋白质都是天然高分子 |

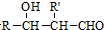
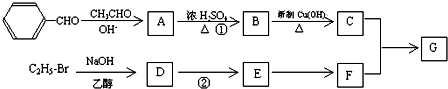
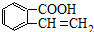 、
、