题目内容
 某研究性学习小组为了证明某酸HmA是强酸还是弱酸,设计了如下实验方案,请回答有关问题:
某研究性学习小组为了证明某酸HmA是强酸还是弱酸,设计了如下实验方案,请回答有关问题:(1)当m=l时,测定0.1mol/L HA的pH值,若测得0.1mol/L HA的pH=2,说明HA为
(2)取少量HmA固体溶于蒸馏水,向所得溶液中滴加2滴石蕊试液,若溶液由无色变成蓝色,证明HmA是
(3)室温下,将pH=2的酸和pH=12的碱B(0H)n等体积混合,测得混合液的pH=10,若生成的正盐中只有一种离子能水解.则该离子水解的离子方程式为
若m、n都为1,所得混合液中各离子的物质的量浓度由大到小的顺序是
(4)现有相同浓度的HA1、HA2两种溶液、蒸馏水、常见指示剂(如石蕊、酚酞)、pH试纸以及常用的实验仪器,有两位同学进行试验:一位同学取少量HA1溶液,滴加2滴石蕊试液,试液变红.微热,观察发现溶液红色加深,推断HA1为
考点:弱电解质在水溶液中的电离平衡,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:证明HmA为弱酸,可从以下角度判断:①看其在水溶液中的电离程度,若部分电离,则为弱酸;②看是否存在电离平衡,若存在电离平衡,则为弱酸;③测NamA溶液的酸碱性,若显碱性,则为弱酸,据此解答即可.
解答:
解:证明HmA为弱酸,可从以下角度判断:①看其在水溶液中的电离程度,若部分电离,则为弱酸;②看是否存在电离平衡,若存在电离平衡,则为弱酸;③测NamA溶液的酸碱性,若显碱性,则为弱酸;
(1)当m=l时,测定0.1 mol/L HA的pH值,若测得0.1mol/L HA的pH=2,则HA部分电离,能说明HA是弱酸;向此溶液中加入稀NaOH溶液,使其恰好完全反应,所得溶液为NaA溶液,为强碱弱酸盐溶液,水解显碱性,pH>7,用离子方程式表示其原因A-+H2O?HA+OH-,故答案为:弱;>;A-+H2O?HA+OH-;
(2)取少量NamA固体溶于蒸馏水,向所得溶液中滴加2滴石蕊试液,若溶液由无色变成蓝色,说明NamA溶液显碱性,NamA为强碱弱酸盐水解显碱性,证明HmA是弱酸;若某浓度的NamA溶液pH=9,则溶液中c(H+)=1×10-9mol/L,c(OH-)=1×10-5mol/L,而溶液中H+和OH-均来自水的电离,则该溶液中水电离的c(OH-)=1×10-5mol/L;故答案为:弱;1×10-5;
(3)室温下,将pH=2的酸HmA和pH=12的碱B(OH)n等体积混合,测得混合液的pH=10,显碱性,则二者反应碱过量,说明HmA为强酸,B(OH)n为弱碱;生成的正盐中只有Bn+能水解,水解的离子方程式为:Bn++nH2O?B(OH)n+nH+;若m、n都为1,所得混合液显碱性,则c(OH-)>c(H+),根据电荷守恒知,c(B+)>c(A-),各离子的物质的量浓度由大到小的顺序是:c(B+)>c(A-)>c(OH-)>c(H+),故答案为:Bn++nH2O?B(OH)n+nH+;c(B+)>c(A-)>c(OH-)>c(H+);
(4)取少量HA1溶液,滴加2滴石蕊试液,试液变红.微热,观察发现溶液红色加深,说明HA1溶液中存在电离平衡,弱电解质的电离吸热,升温,促进电离,红色加深,推断HA1为弱酸;取少量HA2溶液,测定其pH,然后将溶液稀释100倍,再测其pH,对比两次测定的pH相差2,据此推断HA2为强酸,故答案为:弱;强.
(1)当m=l时,测定0.1 mol/L HA的pH值,若测得0.1mol/L HA的pH=2,则HA部分电离,能说明HA是弱酸;向此溶液中加入稀NaOH溶液,使其恰好完全反应,所得溶液为NaA溶液,为强碱弱酸盐溶液,水解显碱性,pH>7,用离子方程式表示其原因A-+H2O?HA+OH-,故答案为:弱;>;A-+H2O?HA+OH-;
(2)取少量NamA固体溶于蒸馏水,向所得溶液中滴加2滴石蕊试液,若溶液由无色变成蓝色,说明NamA溶液显碱性,NamA为强碱弱酸盐水解显碱性,证明HmA是弱酸;若某浓度的NamA溶液pH=9,则溶液中c(H+)=1×10-9mol/L,c(OH-)=1×10-5mol/L,而溶液中H+和OH-均来自水的电离,则该溶液中水电离的c(OH-)=1×10-5mol/L;故答案为:弱;1×10-5;
(3)室温下,将pH=2的酸HmA和pH=12的碱B(OH)n等体积混合,测得混合液的pH=10,显碱性,则二者反应碱过量,说明HmA为强酸,B(OH)n为弱碱;生成的正盐中只有Bn+能水解,水解的离子方程式为:Bn++nH2O?B(OH)n+nH+;若m、n都为1,所得混合液显碱性,则c(OH-)>c(H+),根据电荷守恒知,c(B+)>c(A-),各离子的物质的量浓度由大到小的顺序是:c(B+)>c(A-)>c(OH-)>c(H+),故答案为:Bn++nH2O?B(OH)n+nH+;c(B+)>c(A-)>c(OH-)>c(H+);
(4)取少量HA1溶液,滴加2滴石蕊试液,试液变红.微热,观察发现溶液红色加深,说明HA1溶液中存在电离平衡,弱电解质的电离吸热,升温,促进电离,红色加深,推断HA1为弱酸;取少量HA2溶液,测定其pH,然后将溶液稀释100倍,再测其pH,对比两次测定的pH相差2,据此推断HA2为强酸,故答案为:弱;强.
点评:本题主要考查的是电解质强弱的判断,属于难度较大的题目,注意整理归纳.

练习册系列答案
相关题目
下列离子在溶液中能大量共存的是( )
| A、K+ H+ Fe2+ NO3- |
| B、H+ Al3+ SO42- Cl- |
| C、Na+ Al3+ HCO3- Cl- |
| D、Na+ NH4+ OH- CO32- |
用惰性电极电解饱和Na2CO3溶液,若保持温度不变,则一段时间后( )
| A、溶液的pH变大 |
| B、c(Na+)与c(CO32-)的比值变大 |
| C、溶液浓度变大,有晶体析出 |
| D、实质是电解水,有晶体析出 |
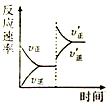 一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g)?pC(g)+qD(s),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )
一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g)?pC(g)+qD(s),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )| A、正反应是放热反应 |
| B、逆反应是放热反应 |
| C、m+n<p+q |
| D、m+n>p+q |
对于0.1mol/L Na2CO3溶液,下列说法正确的是( )
| A、升高温度,溶液的pH降低 |
| B、c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、加入少量NaOH固体,c(CO32-)与c(Na+)均增大 |
| D、c(Na+)+c(H+)=2c(CO32-)+2c(HCO3-)+c(OH-) |
关于铅蓄电池的说法正确的是( )
| A、在放电时,电池中硫酸的浓度不断变小 |
| B、在放电时,正极发生的反应是Pb(s)+SO42-(aq)=PbSO4(s)+2e- |
| C、在充电时,电池中阴极质量不断变小 |
| D、在充电时,阳极发生的反应是 PbSO4(s)+2e-=Pb(s)+SO42-(aq) |
常温下,分别将四块形状相同,质量均为7g的铁片同时放入下列四种溶液中,产生H2的速率最快的是( )
| A、500mL2mol?L-1稀硫酸 |
| B、150mL5mol?L-1稍酸 |
| C、50mL3mol?L-1盐酸 |
| D、500mL2mol?L-1稀硫酸和少量硫酸铜 |