题目内容
19. 铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3大量地用于电镀工业中.
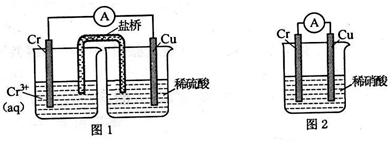
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3大量地用于电镀工业中.(1)在如图装置中,观察到图 1 装置铜电极上产生大量的无色气泡,而图 2 装置中铜电 极上无气体产生,铬电极上产生大量有色气体.
图 2 装置中铬电极的电极反应式NO3-+4H++3e-=NO↑+2H2O.
(2)最近赣州酒驾检查特别严,利用 CrO3 具有强氧化性,有机物(如酒精)遇到 CrO3 时,猛烈反应,CrO3 被还原成绿色的硫酸铬[Cr2(SO4)3],另该过程中乙醇被氧化成乙酸,从而增强导电性,根据电流大小可自动换算出酒精含量.写出该反应的化学方程式为4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O.
(3)虽然铬加到铁中可将铁做成不锈钢可减少金属腐蚀,但 生产成本高,生活中很多情况下还是直接使用钢铁,但易腐蚀,利用右图装置
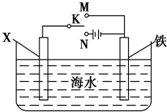 ,可以模拟铁的电化学防护.若 X 为碳棒,为减缓铁的腐蚀,开关 K 应置于N处.若 X 为锌,开关K 置于N或M处.
,可以模拟铁的电化学防护.若 X 为碳棒,为减缓铁的腐蚀,开关 K 应置于N处.若 X 为锌,开关K 置于N或M处.(4)CrO3 和 K2Cr2O7 均易溶于水,这是工业上造成铬污染的主要原因.净化处理方法之一是将含+6 价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的 NaCl 进行电解:阳极区生成的 Fe2+和 Cr2O72-发生反应,生成的 Fe3+和 Cr3+在阴极 区与OH-结合生成 Fe(OH)3和 Cr(OH)3 沉淀除去,已知某条件下的KspFe(OH)3=3.0×10-31,KspCr(OH)3=6.0×10-38.已知电解后的溶液中 c(Fe3+)为 2.0×10-6 mol•L1,则溶液中 c(Cr3+)=4.0×10-13•mol•L-1.
分析 (1)图1装置铜电极上产生大量的无色气泡,说明Cr的活泼性大于Cu,而图 2装置中铜电极上无气体产生,铬电极上产生大量有色气体,说明Cr为正极、Cu为负极,则Cr和硝酸能产生钝化现象,正极上硝酸根离子得电子发生还原反应;
(2)由题目信息可知,CrO3、C2H5OH、H2SO4反应生Cr2(SO4)3、CH3COOH,同时还有水生成,配平书写方程式;
(3)为减缓铁的腐蚀,形成原电池时Fe作正极,形成电解池时Fe作阴极;
(4)根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)、Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)计算c(Cr3+).
解答 解:(1)图1装置铜电极上产生大量的无色气泡,说明Cr的活泼性大于Cu,而图 2装置中铜电极上无气体产生,铬电极上产生大量有色气体,说明Cr为正极、Cu为负极,则Cr和硝酸能产生钝化现象,正极上硝酸根离子得电子发生还原反应生成NO,电极反应式为:NO3-+4H++3e-=NO↑+2H2O,
故答案为:NO3-+4H++3e-=NO↑+2H2O;
(2)由题目信息可知,CrO3、C2H5OH、H2SO4反应生Cr2(SO4)3、CH3COOH,同时还有水生成,反应方程式为:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O,
故答案为:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O;
(3)若 X 为碳棒,开关 K 应置于M处,构成原电池,Fe为负极,加速Fe的腐蚀,开关 K 应置于N处,构成原电池,Fe为阴极,被保护,减缓铁的腐蚀,
若 X 为锌,开关 K 应置于M处,构成原电池,Zn为负极,Fe被保护,减缓铁的腐蚀,开关 K 应置于N处,构成原电池,Fe为阴极,被保护,减缓铁的腐蚀,
故答案为:N;N或M;
(4)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.0×10-6×c3(OH-)=3.0×10-31,
Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.0×10-38
联立可得c(Cr3+)=4.0×10-13mol/L,
故答案为:4.0×10-13.
点评 本题考查较综合,涉及电化学知识、氧化还原反应、溶度积有关计算等,较好的考查学生信息获取与加工能力及图象分析能力、知识迁移运用能力,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 盐酸 | B. | 硫酸钡 | C. | 蔗糖 | D. | 浓氨水 |
| 实验操作 | 实验现象 | 实验结论 | |
| A | 向未知液中滴加氯水,再滴加KSCN溶液 | 溶液呈红色 | 未知液中一定含有Fe2+ |
| B | 向无色溶液中滴加氯水,再加CCl4振荡,静置 | 溶液分层,下层呈紫红色 | 无色溶液中一定含I- |
| C | 某气体通入品红溶液中 | 红色褪去 | 该气体中一定含SO2 |
| D | 将豆粒大金属钾投入水中 | 钾熔化成小球,在水面上游动 | 金属钾密度一定小于水 |
| A. | A | B. | B | C. | C | D. | D |
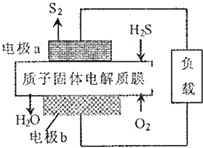 H2S利用是回收能最并得到单质硫.反应原理为:2H2S(g)+02(g)═S2(s)+2H20(1)△H=-632kJ•mol-1.下图为质子膜H2S燃料电池示意图.下列说法正确的是( )
H2S利用是回收能最并得到单质硫.反应原理为:2H2S(g)+02(g)═S2(s)+2H20(1)△H=-632kJ•mol-1.下图为质子膜H2S燃料电池示意图.下列说法正确的是( )| A. | 该电池可实现把化学能全部转化为电能 | |
| B. | 电极b上发生的电极反应为:02+2H2O+4e-═40H- | |
| C. | 电极a上发生的电极反应为:2H2S-4e-═S2+4H+ | |
| D. | 当有34gH2S参与反应时,有2mo1H+经质子膜进人负极区 |
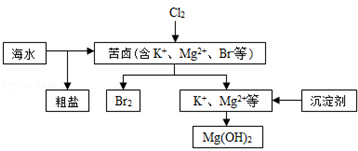
| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂、过滤、蒸发结晶等过程提纯 | |
| C. | 工业生产常选用NaOH作为沉淀剂 | |
| D. | 单质溴可用SO2将其还原吸收 |
①Cl2(HCl):饱和食盐水、过滤 ②CO2(SO2):饱和Na2CO3溶液、洗气
③铁粉(铝粉):NaOH溶液、过滤 ④MnO2(KCl):水、溶解后过滤
⑤碳粉(碘单质):CCl4、分液 ⑥C2H5OH(H2O):加新制CaO后蒸馏.
| A. | ①②③ | B. | ③④⑥ | C. | ②④⑤ | D. | ①④⑤ |
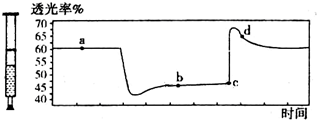 已知2NO2═N2O4+Q (Q>0),将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知2NO2═N2O4+Q (Q>0),将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | c点的操作是拉伸注射器 | |
| B. | b点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| C. | 若反应在一绝热容器中进行,则a、b两点的平衡常数Ka>Kb | |
| D. | d点:v(正)>v(逆) |
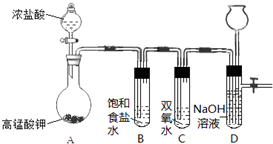 Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化.为了验证某小组学生设计了如下图所示的实验装置进行实验(夹持装置略去).
Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化.为了验证某小组学生设计了如下图所示的实验装置进行实验(夹持装置略去). (1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、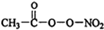 (PAN)等二次污染物.
(PAN)等二次污染物.