题目内容
向饱和澄清石灰水中加入少量CaC2(实验室常用CaC2制乙炔),充分反应后恢复到原来的温度,所得溶液中( )
| A、Ksp[Ca(OH)2]增大 |
| B、c(Ca2+)、c(OH-)均保持不变 |
| C、氢氧化钙的溶解度增大 |
| D、c(OH-)增大、c(H+)减小 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:加入CaC2,与水发生CaC2+2H2O=Ca(OH)2+HC≡CH↑,反应消耗水,结合Ca(OH)2(s)?Ca2+(aq)+2OH-(aq)的影响因素解答.
解答:
解:加入CaC2,与水发生CaC2+2H2O=Ca(OH)2+HC≡CH↑,反应消耗水,因原溶液为饱和溶液,则反应后一定有Ca(OH)2析出,则溶液浓度不变,温度不变,KsP及S均不变,
故选B.
故选B.
点评:本题涉及难溶电解质的溶解平衡,侧重于学生的分析能力的考查,注意把握反应的原理以及溶解平衡的特点,难度不大.

练习册系列答案
相关题目
由14CO和12CO组成的混合气体与同温、同压下空气(平均相对分子质量为29)的密度相同,则下列说法正确的是( )
| A、混合气体中14CO和12CO的分子数之比为2:1 |
| B、混合气体中12CO占有的体积大于14CO占有的体积 |
| C、混合气体中14CO和12CO的质量之比为14:15 |
| D、混合气体中14CO和12CO的密度之比为15:14 |
一定温度下,溴化银在水中的沉淀溶解平衡曲线如图,下列说法正确的是( )


| A、向溴化银的浊液中加入溴化钠溶液,溴化银的Ksp减小 |
| B、向c点的溶液中加入0.1mol?L-1AgNO3,则c(Br-)减小 |
| C、升高温度可以实现c点到b点的转化 |
| D、图中b点对应的是不饱和溶液 |
在体积为0.5L的恒容密闭容器中充入1.25mol N2和1.25mol H2,进行反应:N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ?mol-1,在不同温度下达到平衡时测得H2的体积分数如下表所示,下列说法中不正确的是( )
| T/℃ | 200 | 300 | 400 |
| H2的体积分数 | a1 | a2 | 25% |
| A、a1<a2 |
| B、若反应在400℃下进行,则达到平衡时N2的转化率为20% |
| C、若反应在300℃下进行,则达到平衡时反应放出的热量为23.1 kJ |
| D、若反应在200℃下进行,则达到平衡时N2的体积分数为50% |
有关AgCl沉淀的溶解平衡的说法中,不正确的是( )
| A、AgCl沉淀的生成和溶解不断进行,但速率相等 |
| B、AgCl难溶于水,溶液中没有Ag+和Cl- |
| C、升高温度,AgCl沉淀的溶解度增大 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低 |
已知Fe(OH)3在pH为3.7时完全沉淀,而Ni(OH)2在pH为6.9时才开始沉淀,现在为了除去NiSO4酸性溶液中的Fe3+,可在搅拌的情况下加入一种试剂,过滤后用重结晶法以制备NiSO4?7H2O,则加入的试剂应是( )
| A、NH3?H2O |
| B、NaOH |
| C、NiO |
| D、CaCO3浊液 |
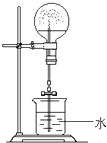 某课外小组同学拟用乙醇分解法制乙烯,并对该反应进行探究.
某课外小组同学拟用乙醇分解法制乙烯,并对该反应进行探究.