题目内容
(1)下列所含分子数由多到少的排列顺序是 .
A.标准状况下33.6L H2
B.所含电子的物质的量为4mol的H2
C.20℃时45g H2O
D.常温下,16g O2与14g N2的混合气体
E.含原子总数约为1.204×1024的NH3
(2)0.4mol OH-的质量为 ,其中含有 个电子.
(3)质量比为16:7:6的三种气体 SO2、CO、NO,分子个数之比为 ;氧原子个数之比为 ;相同条件下体积比为 .
(4)标准状况下,1体积水能溶解448体积HCl,所得溶液的密度为1.3g/mL,该溶液的质量分数和物质的量的浓度分别是 、 .(保留1位小数)
A.标准状况下33.6L H2
B.所含电子的物质的量为4mol的H2
C.20℃时45g H2O
D.常温下,16g O2与14g N2的混合气体
E.含原子总数约为1.204×1024的NH3
(2)0.4mol OH-的质量为
(3)质量比为16:7:6的三种气体 SO2、CO、NO,分子个数之比为
(4)标准状况下,1体积水能溶解448体积HCl,所得溶液的密度为1.3g/mL,该溶液的质量分数和物质的量的浓度分别是
考点:物质的量的相关计算,阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:(1)根据N=nNA知,分子数与物质的量成正比,物质的物质的量越大,其分子数越多;
(2)m=nM,一个氢氧根离子中含有10个电子,根据氢氧根离子构成计算;
(3)根据N=nNA知,分子数之比等于其物质的量之比,再根据n
=计算其物质的量之比,结合分子构成计算氧原子个数之比;根据V=nVm知,气体体积与其物质的量成正比;
(4)假设水的体积是1L,则HCl的体积是448L,n(HCl)=
=20mol,水的质量=1000g,氯化氢的质量=20mol×36.5g/mol=730g,溶液体积V=
=1.33L,根据质量分数、物质的量浓度公式计算.
(2)m=nM,一个氢氧根离子中含有10个电子,根据氢氧根离子构成计算;
(3)根据N=nNA知,分子数之比等于其物质的量之比,再根据n
| m |
| M |
(4)假设水的体积是1L,则HCl的体积是448L,n(HCl)=
| 448L |
| 22.4L/mol |
| 1000g+730g |
| 1300g/L |
解答:
解:(1)根据N=nNA知,分子数与物质的量成正比,物质的物质的量越大,其分子数越多,
A.标准状况下33.6L H2的物质的量=
=1.5mol;
B.所含电子的物质的量为4mol的H2的物质的量=
=2mol;
C.20℃时45g H2O的物质的量=
=2.5mol;
D.常温下,16g O2与14g N2的混合气体的物质的量=
+
=1mol;
E.含原子总数约为1.204×1024的NH3的物质的量=
×
=0.5mol,
所以分子数由多到少顺序是C>B>A>D>E,故答案为:C>B>A>D>E;
(2)0.4mol OH-的质量m=nM=0.4mol×17g/mol=6.8g;一个氢氧根离子中含有10个电子,0.4mol OH-中含有电子数=0.4mol×10×6.02×1023/mol=2.408×1024,
故答案为:6.8g;2.408×1024;
(3)根据N=nNA知,分子数之比等于其物质的量之比,三种气体的物质的量之比=
:
:
=5:5:4;
其分子数之比为5:5:4,结合分子构成知其O原子个数之比=(5×2):(5×1):(4×1)=10:5:4;
根据V=nVm知,气体体积与其物质的量成正比=5:5:4,
故答案为:5:5:4;10:5:4;5:5:4;
(4)假设水的体积是1L,则HCl的体积是448L,n(HCl)=
=20mol,水的质量=1000g,氯化氢的质量=20mol×36.5g/mol=730g,溶液体积V=
=1.33L,
溶液质量分数=
×100%=42.2%;
物质的量浓度=
=14.4mol/L,
故答案为:42.2%;14.4mol/L.
A.标准状况下33.6L H2的物质的量=
| 33.6L |
| 22.4L/mol |
B.所含电子的物质的量为4mol的H2的物质的量=
| 4mol |
| 2 |
C.20℃时45g H2O的物质的量=
| 45g |
| 18g/mol |
D.常温下,16g O2与14g N2的混合气体的物质的量=
| 16g |
| 32g/mol |
| 14g |
| 28g/mol |
E.含原子总数约为1.204×1024的NH3的物质的量=
| 1.204×1024 |
| 6.02×1023/mol |
| 1 |
| 4 |
所以分子数由多到少顺序是C>B>A>D>E,故答案为:C>B>A>D>E;
(2)0.4mol OH-的质量m=nM=0.4mol×17g/mol=6.8g;一个氢氧根离子中含有10个电子,0.4mol OH-中含有电子数=0.4mol×10×6.02×1023/mol=2.408×1024,
故答案为:6.8g;2.408×1024;
(3)根据N=nNA知,分子数之比等于其物质的量之比,三种气体的物质的量之比=
| 16 |
| 64 |
| 7 |
| 28 |
| 6 |
| 30 |
其分子数之比为5:5:4,结合分子构成知其O原子个数之比=(5×2):(5×1):(4×1)=10:5:4;
根据V=nVm知,气体体积与其物质的量成正比=5:5:4,
故答案为:5:5:4;10:5:4;5:5:4;
(4)假设水的体积是1L,则HCl的体积是448L,n(HCl)=
| 448L |
| 22.4L/mol |
| 1000g+730g |
| 1300g/L |
溶液质量分数=
| 730g |
| 1000g+730g |
物质的量浓度=
| 20mol |
| 1.33L |
故答案为:42.2%;14.4mol/L.
点评:本题考查了物质的量的有关计算,熟悉基本公式并灵活运用公式来分析解答,知道公式中各个物理量之间的关系,题目难度不大.

练习册系列答案
相关题目
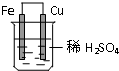 在盛有稀硫酸的烧杯中放入用导线连接的铁片和铜片,下列叙述正确的是( )
在盛有稀硫酸的烧杯中放入用导线连接的铁片和铜片,下列叙述正确的是( )| A、正极的反应式为:Cu2++2e-=Cu |
| B、铁片逐渐溶解,反应式为:Fe-3e-=Fe3+ |
| C、负极是电子流入的电极 |
| D、铜片为正极,发生了还原反应,可观察到气泡产生 |
下列溶液中,物质的量浓度最大的是( )
| A、将40gNaOH溶于水并配成1L的溶液 |
| B、0.5 L含49gH2SO4的溶液 |
| C、将1molNa2O 溶于水并配成1L的溶液 |
| D、含K+为1mol?L-1的K2SO4溶液 |
 (1)一定温度下,向1L密闭容器中加入1mol HI(g),发生2HI(g)?H2(g)+I2(g)反应,H2物质的量随时间的变化如图所示.0~2min内的平均反应速率v(HI)=
(1)一定温度下,向1L密闭容器中加入1mol HI(g),发生2HI(g)?H2(g)+I2(g)反应,H2物质的量随时间的变化如图所示.0~2min内的平均反应速率v(HI)=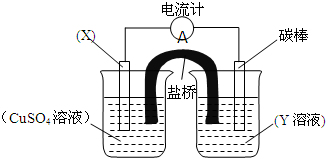 依据氧化还原反应:2Fe3++Cu=Cu2++2Fe2+设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Fe3++Cu=Cu2++2Fe2+设计的原电池如图所示.请回答下列问题: