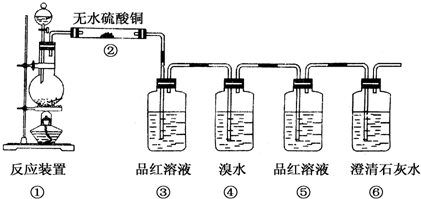
题目内容
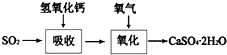
2.(1)硫酸工业、海水的综合利用在国民经济中占有重要地位.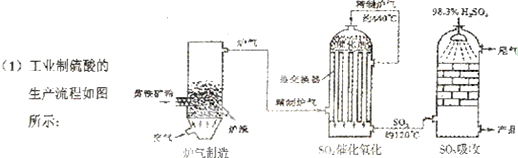
①工业上制硫酸通常以黄铁矿为原料,经过造气、催化氧化、吸收三个主要生产阶段;
②硫酸生产的尾气中含有少量SO2,通常用氨水来吸收处理;
③从实验室制取硫酸到化工厂大规模生产硫酸应考虑哪些方面的问题?原料的获取,工艺流程,尾气处理,厂址选择等.
(2)如图是海水资源综合利用的示意图,据此回答:
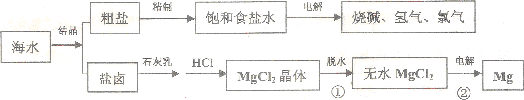
①海水制盐的方法是蒸发结晶,过程①中主要的操作方法是蒸发.
②海水制盐分离出食盐后的卤水中含有氯化镁,可以从卤水中提取的金属是镁.过程②电解熔融MgCl2的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
分析 (1)①依据工业制硫酸的工艺流程分析回答,工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧造气、催化氧化、吸收;
②吸收塔排放的尾气中含有少量的SO2,防止污染大气、充分利用原料,通常用氨水来吸收处理;
③从实验室制取硫酸到化工厂大规模生产硫酸应考虑生产成本、生产工艺、环境保护方面来分析;
(2)①可以用蒸发溶剂的方法得到氯化钠晶体,物质失去结晶水的过程是蒸发浓缩,冷却结晶的过程;②电解熔融的氯化镁可以得到金属镁和氯气.
解答 解:(1)①工业制硫酸通常以黄铁矿为原料经过如下反应三步:
第一步:SO2的制取(造气),主要原料是黄铁矿和空气,在高温下煅烧,使硫元素转变成SO2气体,反应方程式为4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+8SO2,设备为沸腾炉;
第二步:SO3的制取(催化氧化),从沸腾炉中出来的气体需经过净化、除尘,进入接触室在催化剂作用下SO2和O2反应生成SO3,设备为接触室;
第三步:硫酸的生成(吸收),从接触室中出来的气体进入吸收塔,为避免酸雾形成需用98.3%浓H2SO4吸收;
故答案为:黄铁矿;催化氧化;
②SO2通常用足量氨水吸收,然后再用稀硫酸处理,发生SO2+2NH3+H2O=(NH4)2SO3(或SO2+NH3+H2O=NH4HSO3)、(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O
[或2NH4HSO3+H2SO4=(NH4)2SO4+2SO2↑+2H2O],优点为生成的(NH4)2SO4作化肥,二氧化硫可循环利用,
故答案为:氨水;
③从实验室制取硫酸到化工厂大规模生产硫酸应考虑生产成本、生产工艺、环境保护等因素,比如原料的获取,工艺流程,环境保护方面:即要考虑尾气处理,还要考虑厂址的选择,
故答案为:原料的获取,工艺流程,尾气处理,厂址选择等;
(2)①海水制盐的方法是将海水中的水蒸发从而得到氯化钠晶体的过程,氯化镁的结晶水合物失去结晶水的过程是蒸发,但是要在氯化氢气流中进行,因为镁离子易水解,故答案为:蒸发结晶;蒸发;
②电解熔融的氯化镁可以得到金属镁和氯气,方程式为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,
故答案为:镁;MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
点评 本题考查浓硫酸的制备,把握制备浓硫酸的工艺流程及设备的作用,另外考查海水资源以及综合应用,注意电解方程式的书写知识,难度不大.

| A. | HX、HY、HZ的酸性依次增强 | B. | 离子浓度:c(Z-)>c(Y-)>c(X-) | ||
| C. | 电离常数:K(HZ)<K(HY) | D. | c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) |
| A. | 燃烧 | B. | 银镜反应 | ||
| C. | 水解反应 | D. | 与新制备的Cu(OH)2反应 |
| A. | 节日燃放的烟花,就是碱金属以及锶、钡等金属化合物焰色反应所呈现的色彩 | |
| B. | 铝制饭盒不宜长时间存放酸性或碱性的食物 | |
| C. | 可以用ClO2、O2代替Cl2对自来水进行消毒 | |
| D. | 玛瑙饰物的主要成分与制造计算机芯片的主要成分相同 |
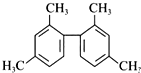
| A. | 该物质所有原子均可共面 | |
| B. | 分子中至少有10个碳原子处于同一平面上 | |
| C. | 分子中至少有11个碳原子处于同一平面上 | |
| D. | 该有机物苯环上的一溴代物有6种 |
 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p轨道有3个未成对电子;C的基态原子2p轨道有1个未成对电子;E原子最外层有1个未成对电子,其次外层有3种原子轨道且均排满电子,;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p轨道有3个未成对电子;C的基态原子2p轨道有1个未成对电子;E原子最外层有1个未成对电子,其次外层有3种原子轨道且均排满电子,;D与E同周期,价电子数为2.则: