题目内容
如图烧杯中盛有稀硫酸,则:
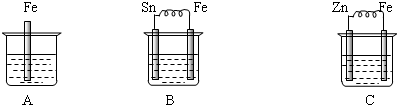
(1)A进行的离子反应方程式为 .
(2)B中各电极的电极反应式:负极 ;正极: .
(3)C中被腐蚀的金属是 ,正极反应式为 .
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是 .

(1)A进行的离子反应方程式为
(2)B中各电极的电极反应式:负极
(3)C中被腐蚀的金属是
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)铁为活泼金属,可与稀硫酸发生反应生成氢气;
(2)铁做负极,锡做正极,电解质溶液为硫酸,则负极发生氧化反应,正极发生还原反应;
(3)锌比铁活泼,做原电池的负极而被氧化;
(4)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护.
(2)铁做负极,锡做正极,电解质溶液为硫酸,则负极发生氧化反应,正极发生还原反应;
(3)锌比铁活泼,做原电池的负极而被氧化;
(4)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护.
解答:
解:(1)铁为活泼金属,可与稀硫酸发生反应生成氢气,反应的离子方程式为Fe+2H+═Fe2++H2↑,
故答案为:Fe+2H+═Fe2++H2↑;
(2)B为原电池装置,Fe较活泼,wie原电池的负极,发生氧化反应,电极方程式为Fe=Fe2++2e,Sn为正极,发生还原反应,电极方程式为2H++2e-=H2↑,
故答案为:Fe=Fe2++2e;2H++2e-=H2↑;
(3)Zn比Fe活泼,形成原电池反应,锌被氧化,正极发生还原反应生成氢气,电极方程式为2H++2e-=H2↑,
故答案为:Zn;2H++2e-=H2↑;
(4)A发生化学腐蚀,B发生电化学腐蚀,C锌比铁活泼,铁做原电池的正极而被保护,电化学腐蚀的速率大于化学腐蚀的速率,腐蚀速率由快到慢的顺序为B>A>C,
故答案为:B>A>C.
故答案为:Fe+2H+═Fe2++H2↑;
(2)B为原电池装置,Fe较活泼,wie原电池的负极,发生氧化反应,电极方程式为Fe=Fe2++2e,Sn为正极,发生还原反应,电极方程式为2H++2e-=H2↑,
故答案为:Fe=Fe2++2e;2H++2e-=H2↑;
(3)Zn比Fe活泼,形成原电池反应,锌被氧化,正极发生还原反应生成氢气,电极方程式为2H++2e-=H2↑,
故答案为:Zn;2H++2e-=H2↑;
(4)A发生化学腐蚀,B发生电化学腐蚀,C锌比铁活泼,铁做原电池的正极而被保护,电化学腐蚀的速率大于化学腐蚀的速率,腐蚀速率由快到慢的顺序为B>A>C,
故答案为:B>A>C.
点评:本题考查金属的电化学腐蚀与防护,题目难度不大,注意金属的电化学腐蚀与化学腐蚀的区别,以及比较金属腐蚀快慢的方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用 NA表示阿伏伽德罗常数,下列关于0.2mol?L-1K2SO4溶液说法正确的是( )
| A、1L溶液中K+浓度是0.4mol?L-1 |
| B、500mL溶液中含有0.1NA个K+ |
| C、1L溶液中所含K+和SO42-总数为0.3NA |
| D、2L溶液中SO42-浓度 为0.4mol?L-1 |
下列事实中,不能说明氯的非金属性比硫强的是( )
| A、高氯酸的酸性比硫酸的酸性强 |
| B、氯化氢比硫化氢的热稳定性好 |
| C、氯气通入Na2S溶液中,有淡黄色沉淀生成 |
| D、次氯酸的氧化性比稀硫酸的氧化性强 |
 化学是一门以实验为基础的科学,熟练使用中学化学实验中的常见仪器,熟悉常见实验用品是正确进行实验的基础.试回答以下问题:
化学是一门以实验为基础的科学,熟练使用中学化学实验中的常见仪器,熟悉常见实验用品是正确进行实验的基础.试回答以下问题: