题目内容
下列事实中,不能说明氯的非金属性比硫强的是( )
| A、高氯酸的酸性比硫酸的酸性强 |
| B、氯化氢比硫化氢的热稳定性好 |
| C、氯气通入Na2S溶液中,有淡黄色沉淀生成 |
| D、次氯酸的氧化性比稀硫酸的氧化性强 |
考点:非金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度判断.
解答:
解:A、非金属性越强,最高价氧化物的水化物的酸性越强,所以高氯酸的酸性比硫酸强,说明氯的非金属性比硫强,故A不选;
B、非金属性越强,氢化物的稳定性越强,氯化氢比硫化氢更稳定,能说明氯的非金属性比硫强,故B不选;
C、非金属性强的能置换非金属性弱的,氯气通入Na2S溶液中,溶液有浅黄色混浊,能说明氯的非金属性比硫强,故C不选;
D、含氧酸的氧化性不能判断非金属性,所以不能说明氯的非金属性比硫强,故D选;
故选D.
B、非金属性越强,氢化物的稳定性越强,氯化氢比硫化氢更稳定,能说明氯的非金属性比硫强,故B不选;
C、非金属性强的能置换非金属性弱的,氯气通入Na2S溶液中,溶液有浅黄色混浊,能说明氯的非金属性比硫强,故C不选;
D、含氧酸的氧化性不能判断非金属性,所以不能说明氯的非金属性比硫强,故D选;
故选D.
点评:本题考查了非金属性强弱比较,解决该题的关键是明确非金属性强弱比较的判断依据,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和创新思维能力.

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
如图烧杯中盛有稀硫酸,则:
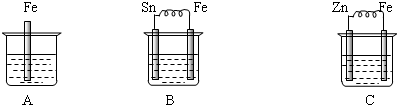
(1)A进行的离子反应方程式为 .
(2)B中各电极的电极反应式:负极 ;正极: .
(3)C中被腐蚀的金属是 ,正极反应式为 .
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是 .

(1)A进行的离子反应方程式为
(2)B中各电极的电极反应式:负极
(3)C中被腐蚀的金属是
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是
500℃条件下,在恒容密闭容器中,充入1molNO2后达到如下平衡2NO2(g)?N2O4(g),平衡后,向容器内再充入1mol N2O4(g),下列说法正确的( )
| A、容器内气体颜色先变浅后变深,最后比原来还要浅 |
| B、反应向逆反应方向移动,所以NO2的百分含量增大 |
| C、容器中的气体密度始终不变 |
| D、N2O4的体积分数增大 |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA |
| B、常温常压下,16gO2和O3的混合气体中含有的原子总数为NA |
| C、标准状况下,11.2LH2O中含有分子的数目为0.5NA |
| D、2.4g金属镁变成镁离子时失去的电子数目为0.1NA |
下列选项中,化学实验现象的描述、结论或解释均正确的是( )
| A、纯净的H2在Cl2中燃烧/安静地燃烧,并发出苍白色火焰/说明燃烧不一定需要氧气参加 |
| B、分别将蘸有浓氨水和浓硫酸的玻璃棒靠近/产生白烟/NH3能和酸反应生成了相应的铵盐 |
| C、把SO2通入紫色石蕊试液中/石蕊试液先变红,后褪色/说明SO2只具有漂白性 |
| D、把CO2通入硅酸钠溶液中/产生白色胶状沉淀/说明碳酸的酸性比硅酸强 |
 随着日本福岛核电站放射性碘泄漏,碘这种元素被人们所认知.如图是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图.下列说法错误的是( )
随着日本福岛核电站放射性碘泄漏,碘这种元素被人们所认知.如图是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图.下列说法错误的是( )| A、碘的相对原子质量为126.9,原子核内质子数为53 |
| B、碘原子核外共有53个电子,最外层有7个电子 |
| C、碘元素属于非金属元素,碘原子在化学反应中容易得到电子 |
| D、碘盐中含有碘酸钾(KIO3),KIO3中碘元素的化合价为-1价 |
影响化学反应速率的根本原因是( )
| A、温度 | B、催化剂 |
| C、反应物本身性质 | D、浓度 |