题目内容
在标准状况下,由CO和CO2组成的混合气体8.96L,质量为16g.此混合物中CO和CO2物质的量比是 ,CO的质量分数是 ,C和O原子个数比是 ,混合气体的平均相对分子质量是 ,对氢气的相对密度是 .
考点:物质的量的相关计算
专题:计算题
分析:根据体积结合n=
=
可列方程式组解答该题.
| V |
| Vm |
| m |
| M |
解答:
解:设CO为xmol,CO2为ymol,
则
,
x=0.1,y=0.3,
此混合物中CO和CO2的物质的量比是0.1:0.3=1:3,
CO的质量分数是
×100%=17.5%,
C和O的原子个数比是 (0.1+0.3):(0.1+2×0.3)=4:7,
混合气体的平均摩尔质量是
=40g/mol,则平均相对分子质量为40,
对氢气的相对密度是
=20,
故答案为:1:3;17.5%;4:7;40;20.
则
|
x=0.1,y=0.3,
此混合物中CO和CO2的物质的量比是0.1:0.3=1:3,
CO的质量分数是
| 0.1mol×28g/mol |
| 16g |
C和O的原子个数比是 (0.1+0.3):(0.1+2×0.3)=4:7,
混合气体的平均摩尔质量是
| 16g |
| 0.1mol+0.3mol |
对氢气的相对密度是
| 40 |
| 2 |
故答案为:1:3;17.5%;4:7;40;20.
点评:本题综合考查物质的量的计算,侧重于学生的计算能力的考查,注意把握相关计算公式列式解答该题,难度不大.

练习册系列答案
相关题目
在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是( )
| A、pH=2的硝酸和pH=12的Ba(OH)2溶液 |
| B、pH=3的盐酸和pH=11的氨水 |
| C、pH=3的硫酸和pH=11的KOH |
| D、pH=4的醋酸和pH=10的KOH溶液 |
如图烧杯中盛有稀硫酸,则:
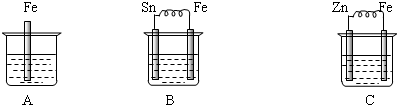
(1)A进行的离子反应方程式为 .
(2)B中各电极的电极反应式:负极 ;正极: .
(3)C中被腐蚀的金属是 ,正极反应式为 .
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是 .

(1)A进行的离子反应方程式为
(2)B中各电极的电极反应式:负极
(3)C中被腐蚀的金属是
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是
 随着日本福岛核电站放射性碘泄漏,碘这种元素被人们所认知.如图是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图.下列说法错误的是( )
随着日本福岛核电站放射性碘泄漏,碘这种元素被人们所认知.如图是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图.下列说法错误的是( )| A、碘的相对原子质量为126.9,原子核内质子数为53 |
| B、碘原子核外共有53个电子,最外层有7个电子 |
| C、碘元素属于非金属元素,碘原子在化学反应中容易得到电子 |
| D、碘盐中含有碘酸钾(KIO3),KIO3中碘元素的化合价为-1价 |