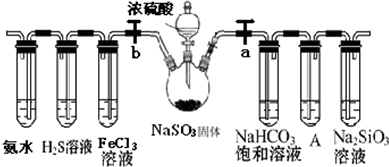
题目内容
某烃0.1mol与15L氧气(过量)点燃后,将生成的混合气体通入足量的碱石灰中,使之完全反应,此时碱石灰增重24.8g,同时得到1.56L气体.该烃常温下不能与稀溴水反应使之褪色.求该烃的分子式,并写出该烃所有同分异构体的键线式.(以上气体体积均在标准状况下测得)
考点:有关有机物分子式确定的计算
专题:
分析:氧气是过量的,则该烃完全反应生成二氧化碳和水,碱石灰增重的为质量为二氧化碳和水的质量;剩余的1.56L气体为氧气,据此可以计算出反应消耗的氧气的物质的量,然后设出二氧化碳、水的物质的量,利用总质量、氧原子守恒列式计算出二氧化碳和水的物质的量,再利用质量守恒确定有机物的分子式;
该有机物不能使溴水褪色,其分子中不存在碳碳双键,说明其分子中一定含有碳环,根据分子式确定其键线式.
该有机物不能使溴水褪色,其分子中不存在碳碳双键,说明其分子中一定含有碳环,根据分子式确定其键线式.
解答:
解:O2过量,该烃与氧气反应生成二氧化碳和水,设二氧化碳的物质的量为xmol,水的物质的量为ymol,
碱石灰增重的24.8g为二氧化碳和水的质量,剩余的1.56L为氧气,
则反应消耗的氧气的物质的量为:
=0.6mol,
根据二氧化碳和水的质量可得:①44x+18y=24.8,
根据氧原子守恒可得:②2x+y=0.6×2,
根据①②解得:
,
即:0.1mol该烃中含有0.4molC、0.8molH,
该有机物分子中含有的C、H数目为:N(C)=
=4、N(H)=
=8,
该有机物的分子式为:C4H8,
该烃常温下不能与稀溴水反应使之褪色,其分子中不存在碳碳双键,则其分子中含有一个碳环,可能为环丁烷: 或甲基环丙烷:
或甲基环丙烷: ,
,
答:该烃的分子式为C4H8,该烃所有同分异构体的键线式为 、
、 .
.
碱石灰增重的24.8g为二氧化碳和水的质量,剩余的1.56L为氧气,
则反应消耗的氧气的物质的量为:
| 15L-1.56L |
| 22.4L/mol |
根据二氧化碳和水的质量可得:①44x+18y=24.8,
根据氧原子守恒可得:②2x+y=0.6×2,
根据①②解得:
|
即:0.1mol该烃中含有0.4molC、0.8molH,
该有机物分子中含有的C、H数目为:N(C)=
| 0.4mol |
| 0.1mol |
| 0.8mol |
| 0.1mol |
该有机物的分子式为:C4H8,
该烃常温下不能与稀溴水反应使之褪色,其分子中不存在碳碳双键,则其分子中含有一个碳环,可能为环丁烷:
 或甲基环丙烷:
或甲基环丙烷: ,
,答:该烃的分子式为C4H8,该烃所有同分异构体的键线式为
 、
、 .
.
点评:本题考查了有机物分子式的计算、键线式的书写,题目难度中等,注意掌握质量守恒定律在确定有机物分子式中的应用方法,明确键线式的概念及书写方法,试题培养了学生灵活应用所学知识解决实际问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
将2.0molSO2气体和2.0molSO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)?2SO3(g),达到平衡时SO3为nmol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于nmol的是( )
| A、1.6molSO2+0.3molO2+0.4molSO3 |
| B、4.0molSO2+1.0molO2 |
| C、2.0molSO2+1.0molO2+2.0molSO3 |
| D、3.0molSO2+1.0molO2+1.0molSO3 |
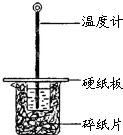 某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法不正确的是( )
某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法不正确的是( )| A、该实验也可在保温杯中进行 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎纸条的作用是保温、隔热,减少热量损失 |
| D、若将盐酸体积改为60 mL,两次实验所求得中和热不相等 |
甲、乙、丙、丁四种物质之间存在如图所示转化关系,且甲、乙、丙均含有相同的某种元素.下列推断错误的是( )甲
乙
丙.
| 丁 |
| 丁 |
| 甲 |
| A、若丙为CO2,则甲可以是焦炭 |
| B、若丁为O2,则甲可以是N2 |
| C、若丁为Fe,则甲可以是Cl2 |
| D、若丁为CO2,则甲可以是NaOH溶液 |
常温下,有甲、乙两份体积为1L、浓度均为0.1mol.?L-1的醋酸溶液,其pH为3,①甲用蒸馏水稀释100倍后,溶液的pH变为x; ②乙与等体积、浓度为0.2mol?L-1的NaOH混合,在混合液中:n(CH3COO-)+n(OH-)-n(H+)=y mol.x、y的正确答案组合为( )
| A、3;0.1 |
| B、5;0.2 |
| C、3<x<5;0.1 |
| D、3<x<5;0.2 |
近来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全.电池总反应式为C2H5OH+3O2═2CO2+3H2O,下列说法不正确的是( )
| A、C2H5OH在电池的负极上发生氧化反应 |
| B、1mol乙醇被氧化转移6 mol电子 |
| C、在外电路中电子由负极沿导线流向正极 |
| D、电池正极的电极反应为4H++O2+4e-═2H2O |
下列说法不正确的是( )
| A、浓硝酸保存在玻璃塞的棕色试剂瓶中 |
| B、已经完成定容的500mL 1.0mol?L-1 的NaOH溶液,某同学不慎将容量瓶中溶液洒出,只能重新配制 |
| C、导管口点燃CO时需要验纯,H2加热还原CuO时也需要验纯 |
| D、物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行 |