题目内容
3.下图所示的实验,能达到实验目的是 ( )| A | B | C | D |
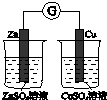 | 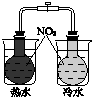 | 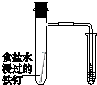 | 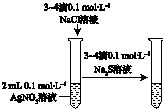 |
| 验证化学能转化为电能 | 证明温度对平衡移动的影响 | 验证铁发生析氢腐蚀 | 验证AgCl溶解度小于Ag2S |
| A. | A | B. | B | C. | C | D. | D |
分析 A.没有构成闭合回路;
B.热水中颜色深,可知温度升高平衡向生成二氧化氮的方向移动;
C.食盐水为中性,发生吸氧腐蚀;
D.硝酸银足量,发生沉淀的生成,而不是转化.
解答 解:A.没有构成闭合回路,不能构成原电池,则不能验证化学能转化为电能,故A错误;
B.热水中颜色深,可知温度升高平衡向生成二氧化氮的方向移动,则图中装置可证明温度对平衡移动的影响,故B正确;
C.食盐水为中性,发生吸氧腐蚀,而酸性条件下发生析氢腐蚀,故C错误;
D.硝酸银足量,发生沉淀的生成,而不是转化,则不能验证AgCl溶解度小于Ag2S,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握原电池、平衡移动、电化学腐蚀、沉淀的生成为解答的关键,侧重分析与实验能力的考查,注意反应原理与实验的结合,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
14.下列叙述正确的是( )
| A. | SO2具有还原性,故可作漂白剂 | |
| B. | Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg | |
| C. | 浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| D. | CaCO3在水中的溶解度很小,故CaCO3为弱电解质 |
11.下列电离方程式书写正确的是( )
| A. | NaHCO3═Na++H++CO32- | B. | NaHSO4═Na++H++SO42- | ||
| C. | Al2(SO4)3═Al3++SO42- | D. | NH3•H2O═NH4++OH- |
15.糖原[(C6H10O5)n]是一种相对分子质量比淀粉更大的多糖.主要存在于肝脏和肌肉中,常常称为动物淀粉或肝糖.下列有关糖原的叙述中正确的是( )
| A. | 糖原与纤维素互为同分异构体,与淀粉互为同系物 | |
| B. | 糖原能溶于水,有甜味 | |
| C. | 糖原水解的最终产物是葡萄糖 | |
| D. | 糖原具有还原性,是还原性糖 |
12.2010年上海世博会的主题是“城市,让生活更美好”.下列叙述中不正确的是( )
| A. | 世博会前期,净化自来水时加入ClO2作为消毒剂 | |
| B. | 世博会期间,利用可降解的“玉米塑料”替代一次性饭盒,可防止产生白色污染 | |
| C. | 世博停车场安装催化光解设施,可将汽车尾气中的CO和NO反应生成无毒气体 | |
| D. | 世博会中国馆一“东方之冠”使用的钢筋混凝土属于高分子化合物 |
13.下列有关化学用语使用正确的是( )
| A. | CO2的电子式: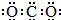 | |
| B. | 具有16个质子、16个中子和18个电子的微粒是${\;}_{16}^{32}$S | |
| C. | 甲酸钠的分子式:CHO2Na | |
| D. | 乙烯的比例模型: |
