题目内容
(17分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
称取研细的黄铜矿样品1.150g,在空气存在的条件下进行煅烧。实验后取d中溶液的1/10置于锥形瓶中,用0.05mo1/L标准碘溶液进行滴定,初读数为0.10mL,终读数如右上图所示。
(1)黄铜矿煅烧的反应为8CuFeS2+21O2高温8Cu+4FeO+2Fe2O3+16SO2,该反应中被还原的元素是___(填元素符号)。
(2)标准碘溶液应盛放在(填“碱式”或“酸式”)________滴定管中;装液之前,滴定管要用标准碘溶液润洗2—3次,润洗的操作是: 。请用化学方程式表示滴定的原理: 。
(3)滴定终点的读数为 mL;通过计算可知,该黄铜矿的纯度为 。
(4)若去掉c装置,会使测定结果 (填“偏低”“偏高”或“无影响”)。
(5)假设实验操作均正确,测得黄铜矿的纯度偏低,可能的原因主要有 。
(17分) (1)Cu、O(2分,各1分)
(2)酸式(2分);往滴定管上口加入3~5mL标准碘溶液,倾斜转动滴定管,使液体润湿全部滴定管内壁,然后,一手控制活塞,将液体从滴定管下部放出(3分,每个要点给1分);
SO2+I2+2H2O=H2SO4+2HI (或H2SO3+I2+H2O=H2SO4+2HI)(2分,配平错误扣1分)
(3)20.10(2分,数位错的不给分);80.4%(2分) (4)偏低(2分)
(5)二氧化硫未能被水充分吸收,亚硫酸部分被氧化(2分,各1分)
解析试题分析:(1)根据方程式可知铜元素的化合价从+2价降低到0价,氧元素的化合价从化0价降低-2价,被还原。硫元素的化合价从-1价升高到+4价,铁元素的化合价从+2价部分升高到+3价,被氧化。
(2)标准碘溶液显酸性应盛放在酸式滴定管中;装液之前,滴定管要用标准碘溶液润洗2—3次,润洗的操作是往滴定管上口加入3~5mL标准碘溶液,倾斜转动滴定管,使液体润湿全部滴定管内壁,然后,一手控制活塞,将液体从滴定管下部放出。SO2检验还原性能被单质碘氧化,则表示滴定原理的方程式为SO2+I2+2H2O=H2SO4+2HI。
(3)滴定管自上而下刻度逐渐增大,且能精确到0.1mol,所以根据装置图可知滴定终点的读数为20.10 mL;因此根据方程式SO2+I2+2H2O=H2SO4+2HI可知消耗SO2的物质的量是0.05mo1/L×0.02010L=0.001005mol,则原矿石中产生的SO2是0.001005mol×10=0.01005mol,所以根据方程式8CuFeS2+21O2高温8Cu+4FeO+2Fe2O3+16SO2可知CuFeS2的物质的量是0.01005mol÷2=0.005025mol,其质量为0.005025mol×184g/mol=0.9246g,则该黄铜矿的纯度为 ×100×=80.4%.
×100×=80.4%.
(4)铜网的作用是除去未反应的氧气,氧气具有氧化性,如果没有装置c,则导致SO2与碘反应时消耗碘溶液的体积减少,从而导致纯度偏低。
(5)假设实验操作均正确,测得黄铜矿的纯度偏低,这说明消耗的标准液碘的体积偏少,因此可能的原因主要有二氧化硫未能被水充分吸收或亚硫酸部分被氧化。
考点:考查氧化还原反应的判断、滴定实验以及含量测定实验方案设计与评价的等

为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe NaNO2
NaNO2 5NaOH → 3Na2FeO2
5NaOH → 3Na2FeO2 H2O
H2O NH3↑
NH3↑
② Na2FeO2 NaNO2
NaNO2 H2O → Na2Fe2O4
H2O → Na2Fe2O4 NH3↑
NH3↑ NaOH
NaOH
③Na2FeO2 Na2Fe2O4
Na2Fe2O4 2H2O
2H2O Fe3O4
Fe3O4 4NaOH
4NaOH
(1)配平化学方程式②。
(2)上述反应①中还原剂为 ,被还原的是 。若有1mol Na2FeO2生成,则反应中有 mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是…………………………………………( )
| A.该生产过程不会产生污染 | B.反应③生成的四氧化三铁具有抗腐蚀作用 |
| C.反应①②③均是氧化还原反应 | D.反应①②中的氧化剂均为NaNO2 |
某化学兴趣小组在探究卤素单质的氧化性的实验中发现,在足量的氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色,原因是什么?Br2能否氧化Fe2+,Fe3+与Br2谁的氧化性更强?
(1)甲同学认为:Br2不能氧化Fe2+,Fe3+的氧化性大于Br2,产生上述现象的原因不是化学反应所致,溶液呈黄色是含 (填化学式,下同)所致。
(2)乙同学认为:Br2将Fe2+氧化为Fe3+,Fe3+的氧化性小于Br2,产生上述现象的原因是化学反应所致,则溶液呈黄色是含 所致。
(3)丙同学为验证乙同学的观点,选择下列试剂,设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的,供选用的试剂:a.酚酞试剂;b.CCl4;c.无水酒精;d.KSCN溶液。请你在下表中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 | 实验现象 |
| 方案1 | |
| 方案2 | |
(4)氧化性:Br2>Fe3+,故在FeCl2中滴入1~2滴溴水,溶液呈黄色。发生反应的离子方程式是 。
(5)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是 。在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有
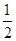 的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度是 。
的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度是 。 如图所示,甲、乙、丙、丁分别代表Na2CO3、NaOH、NaHCO3、CO2四种物质,a、b、c、d、e、f分别表示两种物质间的转化关系。对于图中两种物质间的转化,通过一步反应就能实现的有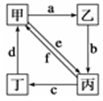
| A.只有a、b、c、d | B.只有b、c、d、e |
| C.只有c、d、e、f | D.a、b、c、d、e、f |
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
 2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol
