题目内容
硫酸钠-过氧化氢-氯化钠加合物(xNaSO4·yH2O2·zNaCl)又称固体双氧水,是一种新型精细化工产品,具有漂白、杀菌、消毒等作用。为探究该加合物的组成,某化学兴趣小组设计并进行了如下实验:
第一步:准确称取6.945g样品,配制成250.00ml无色溶液A
第二步:准确量取25.00ml溶液A于锥形瓶中,加适量稀硫酸酸化后,用0.0400mol/LKMnO4标准溶液滴定至终点,消耗溶液KMnO420.00ml
第三步:另取25.00ml溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.932g.
请回答下列问题:
(1)欲配制无色溶液A,所需要的仪器除药匙、分析天平、玻璃棒、胶头滴管外,还应有 。
(2)配平下列离子方程式______MnO4-+_____H2O2+_________=______Mn2++_____O2↑+______。
(3)滴定前,KMnO4标准溶液应盛装于中 (填仪器名称),滴定终点现象为 。
(4)第三步能否通过加入AgNO3溶液的方法来测定?为什么
(5)滴定前,滴定管用蒸馏水洗净后,未用KMnO4标准溶液润洗,则Y值______________(填“偏
高 偏低 无影响”)
(6)通过计算确定样品的组成为 。
(1)烧杯、250 mL容量瓶(2分) (2)2,5,6H+,2,5,8H2O(2分)
(3)酸式滴定管(1分)
当滴入最后一滴KMnO4溶液时,待测液颜色由无色变为浅紫色,且半分钟不褪色(2分)
(4)不能(1分) 加入AgNO3溶液使Cl-完全沉淀的同时,要生成Ag2SO4微溶物,会使最终测定结果中z值偏高(2分) (5)偏高(2分) (6)4Na2SO4?2H2O2?NaCl(4分)
解析试题分析:(1)欲配制250.00ml无色溶液A,所需要的仪器除药匙、分析天平、玻璃棒、胶头滴管外,还应有溶解时需要的烧杯以及250ml容量瓶。
(2)高锰酸钾加压强氧化性,在反应中Mn元素的化合价从+7价降低到+2价,得到5个电子。双氧水中氧元素的化合价从-1价升高到0价,失去1个电子。根据电子的得失守恒可知氧化剂高锰酸钾与还原剂双氧水的物质的量之比是2:5。反应在酸性条件下进行,因此反应物还有氢离子参加。又因为原子是守恒的,所以还应该有水生成,因此配平后的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O.。
(3)酸性高锰酸钾溶液具有强氧化性和酸性,因此滴定前,KMnO4标准溶液应盛装于中酸式滴定管中。由于酸性高锰酸钾溶液显紫红色,所以滴定终点现象为当滴入最后一滴KMnO4溶液时,待测液颜色由无色变为浅紫色,且半分钟不褪色。
(4)根据物质的组成可知,加入AgNO3溶液使Cl-完全沉淀的同时,会生成Ag2SO4微溶物,从而使最终测定结果中z值偏高,所以不能用硝酸银溶液代替。
(5)滴定前,滴定管用蒸馏水洗净后,未用KMnO4标准溶液润洗,则导致酸性高锰酸钾溶液的浓度减小,因此再滴定双氧水时,消耗高锰酸钾溶液的体积增加,从而导致Y值偏高。
(6)25.00ml溶液A消耗高锰酸钾溶液的体积是20.00ml,则250ml溶液A消耗高锰酸钾溶液的体积是200.00ml,则高锰酸钾的物质的量=0.2L×0.0400mol/L=0.00800ml。所以根据反应的方程式可知,消耗双氧水的物质的量=(0.00800mol÷2)×5=0.0200mol。25.00ml溶液A得到白色沉淀0.932g,该固体是硫酸钡,物质的量=0.932g÷233g/mol=0.004mol。所以250.00ml溶液A生成白色沉淀的物质的量是0.04mol,即硫酸钠的物质的量是0.04mol。因此6.945g样品中氯化钠的物质的量=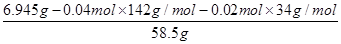 =0.01mol,则x:y:z=0.04:0.02:0.01=4:2:1,因此化学式为4Na2SO4?2H2O2?NaCl。
=0.01mol,则x:y:z=0.04:0.02:0.01=4:2:1,因此化学式为4Na2SO4?2H2O2?NaCl。
考点:考查一定物质的量浓度的配制;氧化还原反应的配平和有关计算;氧化还原滴定仪器选择、误差分析以及物质组成的有关计算

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
A B C D E
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5 PCl3遇水会强烈水解生成 H3PO3和HC1。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为 。
(2)B中所装试剂是 ,
E中冷水的作用是
F中碱石灰的作用是_____
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后.通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40mL
已知:H3PO3+H2O+I2="=" H3PO4+2HI,I2+2Na2S2O3==2NaI+Na2S4O6,假设测定过程中没有其他反应。根据上述数据,该产品中PC13的质量分数为_______。
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: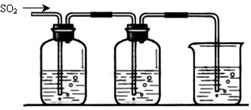
FeCl3溶液 含有淀粉的碘水 NaOH溶液
A B C
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在 中,再加水稀释,这样操作的目的是 。
(2)装置C的作用是 。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、 、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)。
| A.蒸发皿 |
| B.石棉网 |
| C.漏斗 |
| D.烧杯 |
F. 坩埚
(4)根据以上现象,该小组同学认为SO2与 FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式 ;
②请设计实验方案检验有Fe2+生成 ;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42—。该做法 (填“合理”或“不合理”),理由是 。
(5)能表明I-的还原性弱于SO2的现象是 。
某兴趣小组挤究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: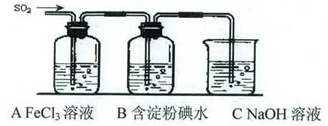
(1)SO2气体还原Fe3+反应的产物是_____________、_____________(填离子符号)。
(2)下列实验方案可以用于在实验室制取所需SO2的是____。
| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与热浓H2SO4 |
(4)如果有280 mL SO2气体(已折算为标态)进入C装置中,则C中50 mL NaOH溶液的浓度至少为_____________mol/L才能达到目的。
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____,原因是_______________________________________。
(6)能表明I-的还原性弱于SO2的现象是_________________________________________,写出有关离子方程式:_______________________________________。
部分氧化的铁铜合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理: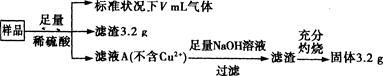
下列说法正确的是 ( )
| A.滤液A中的阳离子为Fe3+、Fe2+、H+ |
| B.V=896 |
| C.样品中CuO的质量为4.0 g |
| D.样品中Fe元素的质量为2.24g |
下列物质不能使红墨水褪色的是( )
| A.活性炭 | B.过氧化钠 | C.NaCl溶液 | D.漂白粉 |
