题目内容
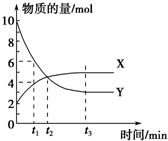
8. 一定温度下,密闭容器内某一反应中X、Y的物质的量随反应时间变化的曲线如图所示,下列叙述中不正确的是( )
一定温度下,密闭容器内某一反应中X、Y的物质的量随反应时间变化的曲线如图所示,下列叙述中不正确的是( )| A. | 反应的化学方程式为:2X?Y | B. | t1时,Y的浓度是X浓度的2倍 | ||
| C. | t2时,正反应速率大于逆反应速率 | D. | t3时,正逆反应速率相等,达到平衡 |
分析 A.根据图示可知,X为生成物、Y为反应物,反应或生成物质的量之比为化学方程式计量数之比;
B.t1时Y、X的物质的量分别为6mol、3mol,设容器体积为1L,根据c=$\frac{n}{V}$计算出二者浓度关系;
C.t2后,XY浓度仍然发生变化,没有达到平衡状态;
D.t3时各组分的浓度不再变化,达到平衡状态;
解答 解:A.依据图象可知,Y的物质的量减小,应该为反应物,X物质的量增加为生成物,YX物质的量变化之比=(8-2):(5-2)=6:3=2:1,正确的化学方程式为:2Y?X,故A错误;
B.t1时Y、X物质的量分别为6mol、3mol,设容器体积为1L,则二者的浓度之比为:$\frac{6mol}{1L}$:$\frac{3mol}{1L}$=2:1,即:Y的浓度是X的浓度的2倍,故B正确;
C.t2后,X的物质的量继续增大,Y的物质的量继续减小,则此时没有达到平衡状态,正反应速率大于逆反应速率,故C正确;
D.t3时X、Y的物质的量不再变化,说明此时达到平衡状态,则正逆反应速率相等,故D正确;
故选A.
点评 本题考查了化学平衡的计算,题目难度中等,根据图象曲线变化正确判断平衡状态为解答关键,注意掌握化学反应速率、物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
18.下列说法中正确的是( )
| A. | 烃是指含有碳、氢元素的有机物 | |
| B. | 燃烧后能产生CO2和H2O的有机物一定是烃 | |
| C. | 天然气、沼气、坑气、煤气的主要成分都是甲烷 | |
| D. | 形成化合物种类最多的元素位于周期表中第二周期第IVA族 |
19.a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和c+离子的电子层结构相同,d与b同族.下列叙述错误的是( )
| A. | c的原子半径是这些元素中最大的 | |
| B. | b与其他三种元素均可形成至少两种二元化合物 | |
| C. | a与其他三种元素形成的二元化合物中其化合价均为+1 | |
| D. | d和a形成的化合物的溶液呈弱酸性 |
3. 一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
 一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为5Y?X | B. | t1时,Y的浓度是X浓度的2倍 | ||
| C. | t2时,正、逆反应速率相等 | D. | t3时,正、逆反应速率相等 |
20.设NA表示阿伏加德罗常数的,下列说法正确的是( )
| A. | 32 g氧气(O2)和32g臭氧(O3)所含氧原子数都为2NA | |
| B. | 18g水中所含电子数为8NA | |
| C. | 常温常压下,1 mol氖气原子数为2NA | |
| D. | 常温常压下,111.2L氮气所含氮原子数为NA |
11.有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
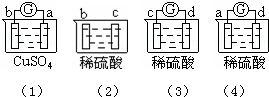
部分实验现象(1)中 a极质量减小,b极质量增加,(2)中 b极有气体产生,c极无变化,(3)中d极溶解,c极有气体产生,(4)中 电流计指示在导线中,电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )

部分实验现象(1)中 a极质量减小,b极质量增加,(2)中 b极有气体产生,c极无变化,(3)中d极溶解,c极有气体产生,(4)中 电流计指示在导线中,电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
| A. | a>b>c>d | B. | b>c>d>a | C. | d>a>b>c | D. | a>b>d>c |
12.某同学到了傍晚时就看不见东西,患了夜盲症,他体内缺少的维生素可能是( )
| A. | 维生素D | B. | 维生素C | C. | 维生素B | D. | 维生素A |
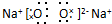 ,甲中的化学键类型为离子键、共价键.
,甲中的化学键类型为离子键、共价键.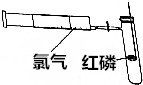 已知SnCl4、SiCl4、AlCl3、PCl3、PCl5等氯化物在潮湿的空气中都有白雾生成.为清楚地观察磷在氯气中燃烧,达到PCl3和PCl5分步生成的目的,可预先把干燥的氯气贮存在100mL的注射器内,再把火柴头大小的红磷置于玻璃燃烧匙上烘干后组成如图所示的装置.
已知SnCl4、SiCl4、AlCl3、PCl3、PCl5等氯化物在潮湿的空气中都有白雾生成.为清楚地观察磷在氯气中燃烧,达到PCl3和PCl5分步生成的目的,可预先把干燥的氯气贮存在100mL的注射器内,再把火柴头大小的红磷置于玻璃燃烧匙上烘干后组成如图所示的装置.