题目内容
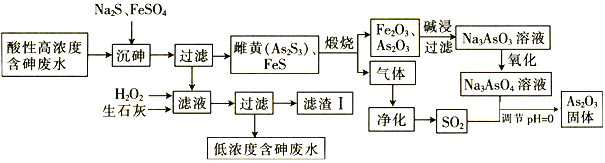
【题目】a、b、c、d四种短周期元素在周期表中的位置如图所示,a和b分别位于周期表的第2列和第13列,下列叙述正确的( )

A.离子半径b>d
B.b可以和强碱溶液发生反应
C.c的最简单氢化物的空间结构为三角锥形
D.a的最高价氧化物对应水化物是强碱
【答案】B
【解析】
根据a、b、c、d四种短周期元素在周期表中的位置,a和b分别位于周期表的第2列和第13列,则a位于第三周期ⅡA族,为Mg元素;b位于第三周期ⅢA族,为Al元素;结合各元素的相对位置可知,c为C元素,d为N元素,据此分析解答。
根据分析可知,a为Mg,b为Al,c为C元素,d为N元素。
A.铝离子和氮离子都含有2个电子层,核电荷数越大,离子半径越小,则离子半径:b<d,故A错误;
B.Al可以与强碱溶液反应生成偏铝酸盐和氢气,故B正确;
C.c的最简单氢化物为甲烷,甲烷为正四面体结构,故C错误;
D.a的最高价氧化物对应水化物为氢氧化镁,氢氧化镁不属于强碱,是中强碱,故D错误;
故选B。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法。某实验兴趣小组将无水FeCl3与氯苯混合发生反应:2FeCl3 +C6H5Cl![]() 2FeCl2 +C6H4Cl2+HC1↑,将生成的HCl用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2。按照如图装置:
2FeCl2 +C6H4Cl2+HC1↑,将生成的HCl用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2。按照如图装置:
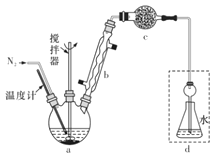
在三颈烧瓶中放入162.5g无水FeCl3与225 g氯苯,控制反应温度在130℃下加热3 h,冷却、过滤,洗涤、干燥得到粗产品。有关数据如表:
C6H5Cl | C6H4Cl2 | AgCl | Ag2CrO4 | |
颜色 | — | — | 白色 | 砖红色 |
溶度积 | — | — | 1.56×10-10 | 9×10-12 |
熔点/℃ | -45 | 53 | — | — |
沸点/℃ | 132 | 173 | — | — |
回答下列问题:
(1)仪器c的名称是_______,盛装的试剂可以是_______________(填字母代号)。
A.碱石灰 B,浓硫酸 C.无水氯化钙 D.固体氢氧化钠
(2)下列各装置(盛有蒸馏水)能代替图中虚线框内部分的是______(填字母代号)。
e. 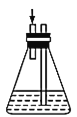 f.
f.  g.
g.  h.
h. 
(3)如何从滤液中回收过量的氯苯:__________。
(4)将锥形瓶内的溶液稀释至1 000 mL,从中取出10. 00 mL,滴加几滴K2CrO4 作指示剂,用0. 200 0 mol/L AgNO3溶液进行滴定,当达到终点时平均消耗22. 50 mL AgNO3溶液。
①滴定终点的现象是________,使用棕色滴定管进行滴定的目的是_________。
②无水FeCl3的转化率α=_______
③上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏________(填“高”或“低”)。