题目内容
【题目】As2O3在玻璃工业中常用作澄清剂和脱色剂,工业上采用酸性高浓度含砷废水(主要以H3AsO3形式存在)提取As2O3的工艺流程如下:
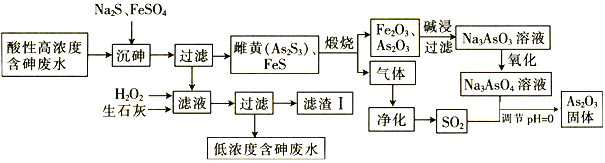
回答下列问题:
(1)上述流程的_____过程中由于条件的原因,造成生成物中混有Fe3O4,为证明Fe3O4的存在,可利用Fe3O4具有_______性的这一物理性质。
(2)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为________。
(3)常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化曲线如图所示:

①H3AsO3为_______元_______(填“强”或“弱”)酸。
②pH由7调节至10的过程中发生反应的离子方程式为__________。
③H3AsO3的一级电离平衡常数Ka1=__________。
(4)滤渣Ⅰ中含有FeAsO4、Fe(OH)3、Ca3(AsO4)2和 _______(填化学式);已知Ksp[FeAsO4]=5.7×10-21 ,含砷污染物允许排放标准为不大于0.5 mgL-1。若低浓度含砷废水(假设砷均以Na3AsO4形式存在)中Fe3+的浓度为1. 0×10-4 molL-1 ,则低浓度含砷废水中Na3AsO4的浓度为_____ mgL-1,_____(填“符合”或“不符合”)排放标准。
【答案】煅烧 磁 2AsO43-+2SO2+2H+=As2O3↓+SO42-+H2O 三 弱 H3AsO3+OH-=H2AsO3-+H2O 10-9 CaSO4 1.1856×10-11 符合
【解析】
酸性高浓度含砷废水加入硫化钠、硫酸亚铁,其中硫酸亚铁可除去过量的硫离子,过滤得到As2S3和FeS,滤液含有亚铁离子以及少量的砷等,加入过氧化氢氧化冶铁离子,加入氢氧化钙可生成FeAsO4、Fe(OH)3、Ca3(AsO4)2,以及硫酸钙等,As2S3和FeS焙烧,可生成As2O3、氧化铁,加入氢氧化钠溶液生成Na3AsO3,氧化生成Na3AsO4,生成的气体为二氧化硫,与Na3AsO4在酸性条件下发生氧化还原反应生成As2O3,据此分析解答。
(1)FeS在煅烧时,可生成有Fe3O4,Fe3O4俗名磁性氧化铁,具有磁性,利用Fe3O4具有磁性检验是否存在Fe3O4,故答案为:煅烧;磁;
(2)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O,故答案为:2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O;
(3)①由图象可知,H3AsO3与NaOH溶液反应生成AsO33-,可说明H3AsO3为三元酸,在根据溶液中还存在和H2AsO3-、HAsO32-,说明H3AsO3为弱酸,故答案为:三;弱;
②根据图象可知,pH由7调至10时,H3AsO3转化为H2AsO3-,反应的离子方程式为:H3AsO3+OH-=H2AsO3-+H2O,故答案为:H3AsO3+OH-=H2AsO3-+H2O;
③根据图象,pH=9时,c(H3AsO3)=c(H2AsO3-),H3AsO3的一级电离方程式为H3AsO3H2AsO3-+H+,平衡常数Ka1= =c(H+)=10-9,故答案为:10-9;
=c(H+)=10-9,故答案为:10-9;
(4)加入石灰水,滤渣I中除含有FeAsO4、Fe(OH)3、Ca3(AsO4)2,还含有CaSO4,Fe3+的浓度为1.0×10-4molL-1,则c(AsO43-)=![]() mol/L=5.7×10-17mol/L,则1L废水中含有As的物质的量为5.7×10-17mol,质量为1.1856×10-11mg,小于0.5mgL-1,符合排放标准,故答案为:CaSO4;1.1856×10-11;符合。
mol/L=5.7×10-17mol/L,则1L废水中含有As的物质的量为5.7×10-17mol,质量为1.1856×10-11mg,小于0.5mgL-1,符合排放标准,故答案为:CaSO4;1.1856×10-11;符合。

 阅读快车系列答案
阅读快车系列答案