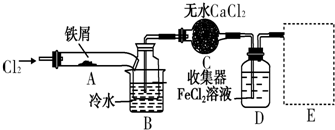
题目内容
8.设NA为阿伏加德罗常数,下列有关叙述正确的是( )| A. | 1 molCu和足量的硫粉加热反应转移的电子数是2NA | |
| B. | 铜粉溶于1L0.5mol/L稀硝酸中,当生成标况下2.24LNO时,溶液中的氮原子数为0.4NA个 | |
| C. | 常温下,4.4克二氧化碳和二氧化氮中的混合物中氧原子数为0.2NA | |
| D. | 标准状况下,11.2升氯气溶于水,转移电子数为0.5 NA |
分析 A.铜与硫反应生成硫化亚铜;
B.根据n=cV计算出硝酸的物质的量,然后利用N原子守恒计算溶液中N原子数目;
C.二氧化碳与二氧化氮摩尔质量不同;
D.氯气与水反应为可逆反应.
解答 解:A.铜与硫反应生成硫化亚铜,1mol铜反应失去1mol电子,个数为:NA,故A错误;
B.1L 0.5mol/L稀硝酸中含有硝酸的物质的量为:0.5mol/L×1L=0.5mol,含有0.5molN原子;当生成标况下2.24LNO(0.1mol)时,根据N原子守恒可知溶液中的氮原子数的物质的量为:0.5mol-0.1mol=0.4mol,含有N原子数为0.4NA个,故B正确;
C.二氧化碳与二氧化氮摩尔质量不同,只知道混合物质量,无法计算各自的物质的量,无法计算含有氧原子数目,故C错误;
D.氯气与水反应为可逆反应,可逆反应不能进行到底,所以标准状况下,11.2升氯气物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,溶于水,转移电子数小于0.5 NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,侧重考查物质所含微粒数目的计算,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确原子守恒规律是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列有关化学用语表示正确的是( )
| A. | N2的电子式: | |
| B. | S2-的结构示意图: | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{58}^{131}$I | |
| D. | 乙烯的分子式:CH2=CH2 |
12.NA表示阿伏加德罗常数,下列说法不正确的是( )
| A. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol•L-1 | |
| B. | 常温常压下,5.6g乙烯与丁烯(C4H8)的混合物中氢原子数为0.8NA | |
| C. | 标准状况下,4.48 LCl2与足量的Fe反应转移电子数为0.4NA | |
| D. | 0.1 mol H218O与D2O的混合物中中子数为NA |
13.少量铁粉与100mL 0.01mol•L-1的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦改用10mL 0.1mol/L盐酸.
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦改用10mL 0.1mol/L盐酸.
| A. | ①②⑥⑦ | B. | ③⑥⑦ | C. | ③⑦ | D. | ④⑤⑦ |
20.一定条件下,在密闭容器中进行如下反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g)△H=-373.2KJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
| A. | 加催化剂同时升高温度 | B. | 加催化剂同时增大压强 | ||
| C. | 升高温度同时充入N2 | D. | 增大压强同时充入NO |
17.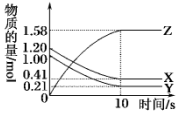 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 反应开始到10 s,用X表示的反应速率为0.158 mol•L-1•s-1 | |
| B. | 反应开始到10 s,Y的物质的量浓度减少了0.79 mol•L-1 | |
| C. | 反应10s时达到化学平衡状态,Z的平衡浓度为0.79 mol•L-1 | |
| D. | 反应的化学方程式为2X(g)+2Y(g)?Z(g) |
18.下列物质的水溶液能够导电,但属于非电解质的是( )
| A. | NaOH | B. | CO2 | C. | 蔗糖 | D. | Al |
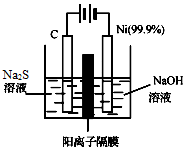 硫及其化合物广泛分布于自然界中,硫酸工业在国民经济中占有极其重要的地位,运用相关原理回答下列问题:
硫及其化合物广泛分布于自然界中,硫酸工业在国民经济中占有极其重要的地位,运用相关原理回答下列问题: