题目内容
13.少量铁粉与100mL 0.01mol•L-1的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦改用10mL 0.1mol/L盐酸.
| A. | ①②⑥⑦ | B. | ③⑥⑦ | C. | ③⑦ | D. | ④⑤⑦ |
分析 可以通过增大盐酸浓度、升高温度等方法来改变,但改变条件时不能加入和稀盐酸反应生成氢气的物质,以此解答该题.
解答 解:①加H2O,浓度减小,反应速率减小,故错误;
②加NaOH固体,中和盐酸,浓度减小,反应速率减小,故错误;
③滴入几滴浓盐酸,浓度增大,反应速率增大,故正确;
④加CH3COONa固体,生成醋酸,浓度减小,反应速率减小,故错误;
⑤加NaCl溶液,氢离子浓度减小,反应速率减小,故错误;
⑥滴入几滴硫酸铜溶液,铁置换出铜,形成原电池反应,反应速率增大,反生成氢气的量减少,故错误;
⑦改用10mL 0.1mol/L盐酸,浓度增大,反应速率增大,且不改变H2的产量,故正确.
故选C.
点评 本题考查化学反应速率影响因素,为高频考点,注意把握浓度、温度、催化剂、反应物接触面积、压强都是影响化学反应速率因素,注意这些外界条件的适用范围,题目难度不大.

练习册系列答案
相关题目
16.下列物质中,不能由单质直接化合生成的是( )
①CuS ②NH3 ③SO3 ④FeCl3 ⑤NO2.
①CuS ②NH3 ③SO3 ④FeCl3 ⑤NO2.
| A. | ①③⑤ | B. | ①②③⑤ | C. | ①②④⑤ | D. | 全部 |
17.设NA表示阿伏加德罗常数的值.下列有关说法中正确的是( )
| A. | 常温常压下,46 gN2O4中含氧原子数为2NA | |
| B. | 常温常压下,11.2 LNH3中含共价键的数目为1.5NA | |
| C. | 电解精炼铜阳极质量减少32 g时电路中转移电子总数为NA | |
| D. | 1 L 0.2 mol/LNa2SO4溶液中含有阴阳离子总数为0.6NA |
1.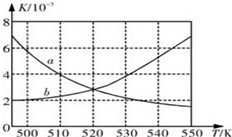 Ⅰ:为了减少CO的排放,某环境研究小组以CO和H2 为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)
Ⅰ:为了减少CO的排放,某环境研究小组以CO和H2 为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)
CH3OCH3(g)+H2O(g)△H=-198kJ/mol.
(1)如图所示能正确反应平衡常数K随温度变化关系的曲线是a(填曲线标记字母),其判断理由是正反应放热,温度升高,平衡常数减小.
(2)在一定温度下,向2.0L固定的密闭容器中充入2molH2和1molCO,经过一段时间后,反应4H2(g)+2CO(g)
CH3OCH3(g)+H2O(g) 达到平衡.反应过程中测得的部分数据见下表:
①0-20min的平均反应速率V(co)=7.5×10-3mol/(L•min);
②达平衡时,H2 的转化率为:80%;
③在上述温度下,向平衡后的2L容器中再充入0.4molH2 和0.4molCH3OCH3 (g),则化学平衡正向(向“正向”、“逆向”或“不”)移动.
(3)用Li2CO3 和Na2CO3 的熔融盐混合物作为电解质,CO为负极燃气,空气与CO2 的混合气体作为正极助燃气,制得在650℃工作的燃料电池,则负极反应式为:2CO+2CO32--4e-=4CO2当燃料电池的电路中有0.2NA个电子发生转移,则标况下生成2.24升CO2.
Ⅱ:已知在25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20,在25℃下,向浓度均为0.1mol/L的MgCl2 和CuCl2 混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀(填化学式)生成该沉淀的离子方程式为Cu2++2NH3•H2O?Cu(OH)2↓+2NH4+.
 Ⅰ:为了减少CO的排放,某环境研究小组以CO和H2 为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)
Ⅰ:为了减少CO的排放,某环境研究小组以CO和H2 为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)CH3OCH3(g)+H2O(g)△H=-198kJ/mol.
(1)如图所示能正确反应平衡常数K随温度变化关系的曲线是a(填曲线标记字母),其判断理由是正反应放热,温度升高,平衡常数减小.
(2)在一定温度下,向2.0L固定的密闭容器中充入2molH2和1molCO,经过一段时间后,反应4H2(g)+2CO(g)
CH3OCH3(g)+H2O(g) 达到平衡.反应过程中测得的部分数据见下表:
| 时间/min | 0 | 20 | 40 | 80 | 100 |
| n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | - |
| n(CO)/mol | 1.0 | - | 0.425 | 0.2 | 0.2 |
| n(CH3OCH3)/mol | 0 | 0.15 | - | - | 0.4 |
| n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
②达平衡时,H2 的转化率为:80%;
③在上述温度下,向平衡后的2L容器中再充入0.4molH2 和0.4molCH3OCH3 (g),则化学平衡正向(向“正向”、“逆向”或“不”)移动.
(3)用Li2CO3 和Na2CO3 的熔融盐混合物作为电解质,CO为负极燃气,空气与CO2 的混合气体作为正极助燃气,制得在650℃工作的燃料电池,则负极反应式为:2CO+2CO32--4e-=4CO2当燃料电池的电路中有0.2NA个电子发生转移,则标况下生成2.24升CO2.
Ⅱ:已知在25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20,在25℃下,向浓度均为0.1mol/L的MgCl2 和CuCl2 混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀(填化学式)生成该沉淀的离子方程式为Cu2++2NH3•H2O?Cu(OH)2↓+2NH4+.
8.设NA为阿伏加德罗常数,下列有关叙述正确的是( )
| A. | 1 molCu和足量的硫粉加热反应转移的电子数是2NA | |
| B. | 铜粉溶于1L0.5mol/L稀硝酸中,当生成标况下2.24LNO时,溶液中的氮原子数为0.4NA个 | |
| C. | 常温下,4.4克二氧化碳和二氧化氮中的混合物中氧原子数为0.2NA | |
| D. | 标准状况下,11.2升氯气溶于水,转移电子数为0.5 NA |
18.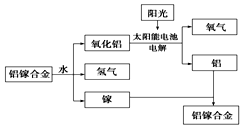 美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示).下列有关该工艺的说法错误的是( )
美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示).下列有关该工艺的说法错误的是( )
 美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示).下列有关该工艺的说法错误的是( )
美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示).下列有关该工艺的说法错误的是( )| A. | 铝镓合金与水反应的化学方程式为2Al+3H2O$\frac{\underline{\;一定条件\;}}{\;}$Al2O3+3H2↑ | |
| B. | 总反应式为2H2O$\frac{\underline{\;一定条件\;}}{\;}$2H2↑+O2↑ | |
| C. | 该过程中,能量的转化形式只有两种 | |
| D. | 铝镓合金可以循环使用 |
5.从下列提供的试剂和操作中选择最佳组合完成从碘水中提取单质碘( )
①酒精 ②苯 ③四氯化碳 ④分液 ⑤萃取 ⑥蒸馏.
①酒精 ②苯 ③四氯化碳 ④分液 ⑤萃取 ⑥蒸馏.
| A. | ②④ | B. | ②④⑤ | C. | ②④⑤⑥ | D. | ③④⑤⑥ |
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 11.2 L CO2所含分子数为0.5 NA | |
| B. | 32gO2和O3的混合气体中含有的氧原子数为2NA | |
| C. | 标况下,11.2L乙醇(C2H5OH)中所含的碳原子数目为NA | |
| D. | 14.2 g Na2SO4固体中阴离子所带电荷数为0.1NA |
3.下列现象或新技术应用中,不涉及胶体性质的是( )
| A. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| B. | 使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血 | |
| C. | 江河入海口常形成三角洲 | |
| D. | 肾衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 |