题目内容
5.已知:反应2A+3B=C+D在某段时间内,以A的浓度变化表示的反应速率为1mol/(L•min),则此段时间内,以C的浓度变化表示的化学反应速率为( )| A. | 0.5 mol/(L•min) | B. | 2mol/(L•s) | C. | 2mol/(L•min) | D. | 3mol/(L•min) |
分析 对应同一个化学反应,反应过程中各物质的反应速率与其化学计量数成正比,据此结合反应2A+3B=C+D及A的反应速率、A与C的计量数之比进行计算.
解答 解:反应2A+3B=C+D中A、C的化学计量数之比为2:1,则反应速率v(A):v(C)=2:1,
以A的浓度变化表示的反应速率为1mol/(L•min),
则1mol/(L•min):v(C)=2:1,
解得:v(C)=0.5 mol/(L•min),
故选A.
点评 本题考查了化学反应速率与化学计量数的关系,题目难度不大,明确化学反应速率与化学计量数成正比为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.

练习册系列答案
相关题目
1.下列有关化学用语表示正确的是( )
| A. | 羟基的电子式: | B. | CH2F2的电子式: | ||
| C. | 对硝基甲苯的结构简式: | D. | 异丙醇的结构简式:CH3CH2CH2OH |
2.胶体的特性是( )
| A. | 有丁达尔现象 | B. | 加热会聚沉 | C. | 电泳 | D. | 胶状 |
20.在众多的新能源中,氢能将会成为21世纪最理想的能源.
Ⅰ.已知101kPa、25℃时,1mol下列物质完全燃烧生成稳定状态化合物时放出的热量数
据如下:
(1)H2燃烧的热化学方程式是2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol.
(2)H2可以代替原煤和汽油作为新能源的依据是相同条件下,等质量的H2燃烧放出的热量大于原煤和汽油,产物无污染,可循环利用.
(3)工业上电解饱和食盐水的副产物之一是H2,反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
Ⅱ.如图所示,硫酸工业中产生的SO2通过下列过程既能制得H2SO4又能制得H2.
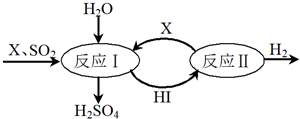
请回答:
(1)该过程可循环利用的物质是I2和HI(写化学式).
(2)该过程总反应的化学方程式是SO2+2H2O=H2SO4+H2.
(3)尾气中的SO2可用NaOH溶液吸收,同时可得含Na2SO3的样品,为测定样品中
Na2SO3的质量分数,甲同学设计实验如下(夹持及加热装置略):
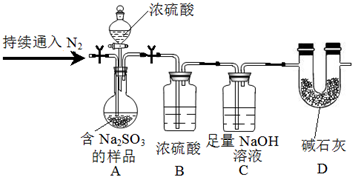
①装置B的作用是干燥SO2.
②测定样品中Na2SO3的质量分数所需的数据是含Na2SO3的样品质量、装置C通入SO2前后的质量.
Ⅰ.已知101kPa、25℃时,1mol下列物质完全燃烧生成稳定状态化合物时放出的热量数
据如下:
| 物质 | 氢气 | 原煤 (主要成份是C) | 汽油 (主要成份C8H18) |
| 热量(kJ) | 285.8 | 250.9 | 4910 |
(2)H2可以代替原煤和汽油作为新能源的依据是相同条件下,等质量的H2燃烧放出的热量大于原煤和汽油,产物无污染,可循环利用.
(3)工业上电解饱和食盐水的副产物之一是H2,反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
Ⅱ.如图所示,硫酸工业中产生的SO2通过下列过程既能制得H2SO4又能制得H2.

请回答:
(1)该过程可循环利用的物质是I2和HI(写化学式).
(2)该过程总反应的化学方程式是SO2+2H2O=H2SO4+H2.
(3)尾气中的SO2可用NaOH溶液吸收,同时可得含Na2SO3的样品,为测定样品中
Na2SO3的质量分数,甲同学设计实验如下(夹持及加热装置略):

①装置B的作用是干燥SO2.
②测定样品中Na2SO3的质量分数所需的数据是含Na2SO3的样品质量、装置C通入SO2前后的质量.
10.下列气体有颜色并有刺激性气味的是( )
| A. | CO | B. | Cl2 | C. | N2 | D. | CO2 |
17.试剂瓶上贴有 标志的物质是( )
标志的物质是( )
 标志的物质是( )
标志的物质是( )| A. | 浓硫酸 | B. | NaCl溶液 | C. | NH4Cl溶液 | D. | Na2SO4溶液 |
14.下列过程中没有发生化学变化的是( )
| A. | 用漂白粉给游泳池的水消毒 | B. | 袋装食品装人硅胶防潮 | ||
| C. | 用小苏打烹制面包 | D. | 袋装食品装人铁粉作抗氧化剂 |
15.为了防止患甲状腺肿大病,市售的食盐中常添加一定量的( )
| A. | 葡萄糖 | B. | 碘酸钾 | C. | 碳酸钠 | D. | 氯化钾 |