题目内容
下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4
④碱性:KOH>Mg(OH)2>Al(OH)3.
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4
④碱性:KOH>Mg(OH)2>Al(OH)3.
| A、①③ | B、②④ | C、①④ | D、②③ |
考点:非金属在元素周期表中的位置及其性质递变的规律,微粒半径大小的比较
专题:元素周期律与元素周期表专题
分析:①非金属性越强,气态氢化物越稳定;
②电子层越多,半径越大;同周期原子序数大的原子半径小;
③非金属性越强,对应最高价氧化物的水化物酸性越强;
④金属性越强,对应最高价氧化物的水化物碱性越强.
②电子层越多,半径越大;同周期原子序数大的原子半径小;
③非金属性越强,对应最高价氧化物的水化物酸性越强;
④金属性越强,对应最高价氧化物的水化物碱性越强.
解答:
解:①非金属性F>O>S,气态氢化物的稳定性为HF>H2O>H2S,故错误;
②电子层越多,半径越大;同周期原子序数大的原子半径小,则原子半径为Na>Mg>O,故正确;
③非金属性Cl>S>P,对应最高价氧化物的水化物酸性为H3PO4<H2SO4<HClO4,故错误;
④金属性K>Mg>Al,对应最高价氧化物的水化物碱性为KOH>Mg(OH)2>Al(OH)3,故正确;
故选B.
②电子层越多,半径越大;同周期原子序数大的原子半径小,则原子半径为Na>Mg>O,故正确;
③非金属性Cl>S>P,对应最高价氧化物的水化物酸性为H3PO4<H2SO4<HClO4,故错误;
④金属性K>Mg>Al,对应最高价氧化物的水化物碱性为KOH>Mg(OH)2>Al(OH)3,故正确;
故选B.
点评:本题考查元素性质的比较及原子半径的比较,为高频考点,把握元素在周期表的位置、性质的比较方法等为解答的关键,侧重规律性知识的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
相关题目
联苯的结构简式: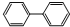 ,下列有关联苯的说法中正确的是( )
,下列有关联苯的说法中正确的是( )
 ,下列有关联苯的说法中正确的是( )
,下列有关联苯的说法中正确的是( )| A、分子中含有6个碳碳双键 |
| B、联苯的一硝基取代产物的3种 |
| C、它容易发生加成反应、取代反应,容易被强氧化剂氧化 |
D、它和蒽(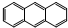 )同属于芳香烃,两者互为同系物 )同属于芳香烃,两者互为同系物 |
短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A和C同主族,B原子的最外层电子数等于A原子的次外层电子数,下列叙述中正确的是( )
| A、原子半径:A<B<C |
| B、C的最简单氢化物的稳定性大于A的最简单氢化物的稳定性 |
| C、高温下,A单质能置换出C单质 |
| D、三种元素的最高价氧化物对应的水化物均可由化合反应得到 |
下列叙述正确的是( )
| A、氯化钠溶液在电流作用下电离成Na+与Cl? |
| B、溶于水后能电离出H+的化合物都是酸 |
| C、氯化氢溶于水后能导电,但液态氯化氢不能导电 |
| D、导电性强的溶液中自由移动离子数目一定比导电性弱的溶液中自由移动离子数目多 |
某元素R的最高正价含氧酸的化学式为HnRO2n-2,则在其气态氢化物中,R的化合价为( )
| A、-(6-3n) |
| B、-(8-n) |
| C、-(12-3n) |
| D、-(14-5n) |
近年用红外激光技术研究液氢,发现液氢中含有H3+.则H3+应该属于( )
| A、单质 | B、分子 | C、原子 | D、离子 |
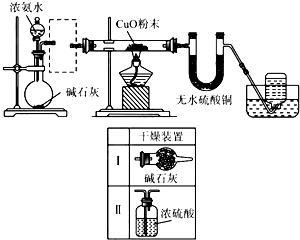 实验室进行某项实验并检验反应产物的装置如图.
实验室进行某项实验并检验反应产物的装置如图.