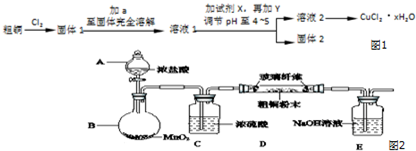
题目内容
5.如图,各烧杯中盛有海水,铁在其中被腐蚀的速度由快到慢的顺序为( )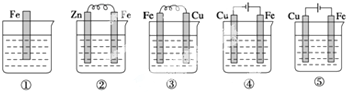
| A. | ①②③④⑤ | B. | ④③②①⑤ | C. | ④③①②⑤ | D. | ④②③①⑤ |
分析 作原电池负极或作电解池阳极的金属加速被腐蚀,作原电池正极或电解池阴极的金属被保护,金属被腐蚀快慢顺序是:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极,据此分析解答.
解答 解:作原电池负极或作电解池阳极的金属加速被腐蚀,作原电池正极或电解池阴极的金属被保护,金属被腐蚀快慢顺序是:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极,
①中铁发生化学腐蚀;
②中铁作正极,被保护;
③中Fe易失电子作负极,加速被腐蚀;
④中铁作阳极,加速被腐蚀;
⑤中铁作阴极,被保护;
通过以上分析知,Fe被腐蚀由快到慢顺序是④③①②⑤,故选C.
点评 本题考查了金属的腐蚀与防护,明确原电池和电解池原理是解本题关键,根据金属发生腐蚀类型及电极类型来确定金属被腐蚀快慢,题目难度不大.

练习册系列答案
相关题目
20.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1mol Na与足量O2反应生成Na2O和Na2O2时,失去的电子数为2NA | |
| B. | 在密闭容器中,加入1mol N2和3mol H2,充分反应后生成NH3分子数为2NA | |
| C. | 足量铁在1mol Cl2中充分燃烧,转移的电子数目为2NA | |
| D. | 32gCu与S完全反应转移的电子数为NA |
16.下列说法正确的是( )
| A. | 任何化学反应都伴随着能量的变化 | |
| B. | H2O(g)→H2O(l)该过程放出大量的热,所以该过程是化学变化 | |
| C. | 化学反应中能量的变化一定都表现为热量的变化 | |
| D. | 氢氧化钡晶体和氯化铵晶体的反应属于放热反应 |
20.公共场所安放的“可回收垃圾”和“不可回收垃圾”两类垃圾箱,其中可以回收的垃圾,如:废弃的旧铜丝、废钢铁、铝制易拉罐等,根据物质的分类它们属于( )
| A. | 有毒的 | B. | 单质 | C. | 氧化物 | D. | 金属或合金 |
10.环境污染已成为人类社会面临的重大威胁.下列名词与环境污染无关的是…( )
①温室效应; ②赤潮; ③酸雨; ④光化学污染;
⑤臭氧空洞; ⑥水俣病; ⑦潮汐; ⑧大脖子病.
①温室效应; ②赤潮; ③酸雨; ④光化学污染;
⑤臭氧空洞; ⑥水俣病; ⑦潮汐; ⑧大脖子病.
| A. | ②⑧ | B. | ⑦⑧ | C. | ⑥⑦⑧ | D. | ②⑤⑦ |
17.下列各组名词或现象中,两者间没有逐级因果关系的是( )
| A. | 汽车尾气的大量排放--光化学污染 | |
| B. | 含磷洗衣粉的大量使用--水体富营养化 | |
| C. | 生活污水任意排放--CO2浓度增大 | |
| D. | 氟氯烃的大量使用--臭氧空洞 |
14.将少量的a溶液加入到b溶液中,现象及对应的离子方程式正确的是( )
| 选项 | a | b | 现象 | 离子方程式 |
| A | 稀硫酸 | KI | 在空气中放置一段时间后溶液呈棕黄色 | 4I-+O2+2H2O=2I2+4OH- |
| B | Na2CO3 | 稀盐酸 | 开始时无气泡,后来有气泡 | CO32-+H+=HCO3-;HCO3-+H+=H2O+CO2↑ |
| C | 稀盐酸 | Na2SiO3 | 产生白色胶状物 | 2H++SiO32-=H2SiO3(胶体) |
| D | 稀H2SO4 | 滴有酚酞的Ba(OH)2 | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |