题目内容
 试用Zn+2H+═Zn2++H2↑的反应设计原电池.
试用Zn+2H+═Zn2++H2↑的反应设计原电池.(1)原电池中使用的电解质溶液是
(2)写出电极反应式:负极:
(3)在方框中画出此原电池的图,标出电极材料的名称.
考点:设计原电池
专题:电化学专题
分析:(1)根据原电池总反应可知,电解质溶液为非强氧化性强酸,如稀硫酸或者稀盐酸;
(2)根据原电池工作原理写出负极、正极的电极反应;
(3)根据反应方程式可知,锌作负极 碳或比锌不活泼的金属作正极,稀硫酸为电解质溶液,据此画出原电池装置图.
(2)根据原电池工作原理写出负极、正极的电极反应;
(3)根据反应方程式可知,锌作负极 碳或比锌不活泼的金属作正极,稀硫酸为电解质溶液,据此画出原电池装置图.
解答:
解:(1)根据反应Zn+2H+═Zn2++H2↑可知,电解质溶液为非氧化性强酸,可以选用稀硫酸或者稀盐酸,
故答案为:稀硫酸(或稀盐酸);
(2)反应Zn+2H+═Zn2++H2↑中,锌在负极失去电子生成锌离子,电极反应为:Zn-2e-═Zn2+;氢离子在正极得到电子生成氢气,发生得到电极反应为:2H++2e-═H2↑,
故答案为:Zn-2e-═Zn2+;2H++2e-═H2↑;
(3)该原电池中,负极材料为金属锌,正极材料可以为铜棒或活泼性比锌若的其它金属材料,电解质溶液为稀硫酸或者稀盐酸,据此画出该原电池装置图为: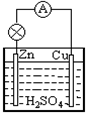 ,故答案为:
,故答案为: .
.
故答案为:稀硫酸(或稀盐酸);
(2)反应Zn+2H+═Zn2++H2↑中,锌在负极失去电子生成锌离子,电极反应为:Zn-2e-═Zn2+;氢离子在正极得到电子生成氢气,发生得到电极反应为:2H++2e-═H2↑,
故答案为:Zn-2e-═Zn2+;2H++2e-═H2↑;
(3)该原电池中,负极材料为金属锌,正极材料可以为铜棒或活泼性比锌若的其它金属材料,电解质溶液为稀硫酸或者稀盐酸,据此画出该原电池装置图为:
 ,故答案为:
,故答案为: .
.
点评:本题考查了原电池工作原理、原电池装置图的设计,题目难度中等,注意掌握原电池工作原理,能够根据反应原理画出正确的原电池装置图.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
下列各组离子能在溶液中大量共存的是( )
| A、Fe3+、H+、Cl-、SCN- |
| B、Fe2+、SO42-、H+、NO3- |
| C、Ca2+、HCO3-、Cl-、Na+ |
| D、K+、NH4+、SO42-、OH- |
下列说法正确的是( )
| A、参加反应物质的性质是决定化学反应速率的主要因素 |
| B、化学反应速率只能加快不能减慢 |
| C、决定化学反应速率的主要因素是浓度 |
| D、增加反应物的用量一定能增大反应速率 |
 氮的单质和化合物在工农业生产中有着广泛的应用.
氮的单质和化合物在工农业生产中有着广泛的应用. 12.硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题:
12.硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题: 选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: