题目内容
11.500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0mol/L,用铅蓄电池作电源,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,求(无相应计算过程不得分)(1)原溶液中K+的浓度?
(2)铅蓄电池的正极质量改变多少?
(3)若将电解后的溶液恢复到电解前的浓度,加一种什么物质;其质量为多少克?
分析 石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),阴极发生反应为:Cu2++2e-═Cu、2H++2e-═H2↑,阳极发生反应为:4OH--4e-═O2↑+2H2O,n(O2)=$\frac{22.4L}{22.4L/mol}$=1mol,结合电子守恒及物质的量浓度的计算来解答.
解答 解:石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),n(O2)=$\frac{22.4L}{22.4L/mol}$=1mol,
阳极发生电极反应为:4OH--4e-═O2↑+2H2O,
4mol 4mol 1mol
阴极发生的电极反应为:Cu2++2e-═Cu、2H++2e-═H2↑
1mol 2mol 1mol 2mol 2mol 1mol
(1)c(Cu2+)=$\frac{1mol}{0.5L}$=2mol/L,由电荷守恒可知,原混合溶液中c(K+)为6mol/L-2mol/L×2=2mol/L,答:原溶液中K+的浓度2mol/L;
(2)铅蓄电池的正极的电极反应式为:PbO2+2e-+4H++SO42-=PbSO4+2H2O,而整个电路转移4mol的电子,所以有2mol的氧化铅放电,质量变化为:2×(96-32)=128g,答:铅蓄电池的正极质量改变128g;
(3)电解过程中铜离子放电,水中氢离子放电,所以加入1mol的Cu(OH)2 恢复到电解前的浓度,质量为98g,答:加一种什么物质是氢氧化铜;其质量为98g.
点评 本题考查混合物计算,题目难度中等,明确发生的电极反应及电子守恒是解答本题的关键,难点是D,注意氢氧根离子与氢离子的关系解答,试题侧重考查学生的分析、理解能力及化学计算能力.

 阅读快车系列答案
阅读快车系列答案| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 3:2 |
| A. | 次氯酸钙溶液中通入过量二氧化碳:ClO-+H2O+CO2═HCO3-+HClO | |
| B. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | 硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+═Fe3++4H2O | |
| D. | 硝酸铁溶液中加过量氨水:Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+ |
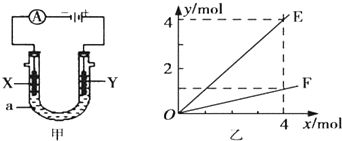
| A. | 若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 | |
| B. | 按图甲装置用惰性电极电解AgNO3溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 | |
| C. | 按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5 mol的碳酸铜刚好恢复到通电前的浓度,则电解过程中转移的电子为2.0 mol | |
| D. | 若X、Y为铂电极,a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol•L-1 |
| A. | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 | |
| B. | 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 | |
| C. | 由氯代环己烷消去制环己烯;由丙烯加溴制1,2二溴丙烷 | |
| D. | 由乙酸和乙醇制乙酸乙酯;由乙酸乙酯酯水解得乙酸和乙醇 |
| A. | 乙酸 | B. | 苯酚 | C. | 水 | D. | 乙醇 |
| A. | CCl4、SiCl4、SiH4 | B. | H2S、NF3、CH4 | C. | BCl3、NH3、CO2 | D. | SO3、BF3、H3O+ |

 .
.