题目内容
3.下列物质中最难电离出H+的是( )| A. | 乙酸 | B. | 苯酚 | C. | 水 | D. | 乙醇 |
分析 根据酸性越强电离生成H+越容易,则最难电离出H+的是酸性最弱的物质或非电解质.
解答 解:A.CH3COOH是一种弱酸,CH3COOH?CH3COO-+H+在水溶液中能电离出H+;
B.C6H5ONa+CH3COOH→C6H6OH+CH3COONa,乙酸电离生成H+比苯酚强,但苯酚显弱酸性,电离出氢离子的能力比水强;
C.水属于极弱电解质,能微弱电离生成H+;
D.C2H5OH属于非电解质,在水中不电离,则不会电离出H+;
四种物质的酸性关系为CH3COOH>C6H6OH>H2O>C2H5OH,即最难电离出H+的是C2H5OH,
故选D.
点评 本题较简单,注重对学生基础知识的考查,明确酸性强弱与电离生成H+的关系是解答本题的关键.

练习册系列答案
相关题目
13.下列酸中,酸性最强的是( )
| A. | HClO | B. | HNO2 | C. | H2SO4 | D. | HClO4 |
14.下列不属于可逆反应的是( )
| A. | 2Na+2H2O?2NaOH+H2↑ | B. | Cl2+H2O?HCl+HClO | ||
| C. | NH3•H2O?NH3+H2O | D. | N2+3H2$?_{高温高压}^{催化剂}$2NH3 |
2. 现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100mL).
现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100mL).
Ⅰ.实验步骤:
(1)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞溶液作指示剂.
(3)读取盛装0.100 0mol/L NaOH溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为0.70mL.
(4)滴定.滴定终点的现象是溶液由无色恰好变为浅红色,并在半分钟内不褪色.
Ⅱ.数据记录:
Ⅲ.数据处理:
某同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4mL=15.24mL.
(5)指出他的计算的不合理之处:第一组数据与后三组数据相差较大,属于异常值,应舍去;按正确数据处理,可得市售白醋总酸量=4.500g/100mL.(结果保留四位有效数字)
 现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100mL).
现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100mL).Ⅰ.实验步骤:
(1)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞溶液作指示剂.
(3)读取盛装0.100 0mol/L NaOH溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为0.70mL.
(4)滴定.滴定终点的现象是溶液由无色恰好变为浅红色,并在半分钟内不褪色.
Ⅱ.数据记录:
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(样品) (mL) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) (mL) | 15.95 | 15.00 | 15.05 | 14.95 |
某同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4mL=15.24mL.
(5)指出他的计算的不合理之处:第一组数据与后三组数据相差较大,属于异常值,应舍去;按正确数据处理,可得市售白醋总酸量=4.500g/100mL.(结果保留四位有效数字)
19.同一主族元素原子序数的差值不可能是( )
| A. | 10、16、32 | B. | 8、18、28 | C. | 16、26、36 | D. | 34、44、54 |
20.要鉴别无瓶签的四氯化碳、苯、酒精、乙酸四瓶液体,下列一种试剂就可行的是( )
| A. | 水 | B. | 石蕊试液 | C. | 氢氧化钠溶液 | D. | 溴水 |
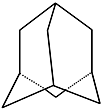 金刚烷的结构如图所示,它可看作是由四个等同的六元环组成的空间构型.
金刚烷的结构如图所示,它可看作是由四个等同的六元环组成的空间构型.