题目内容
19.图是氯气的实验室制法装置图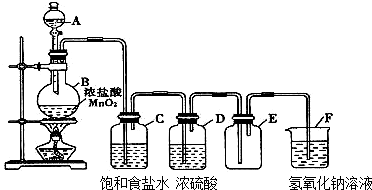
实验室制氯气的原理:MnO2+4HCI(浓)═MnCl2+Cl2↑+2H2O
(1)写出仪器名称:A分液漏斗 B圆底烧瓶
(2)浓硫酸作用干燥氯气,氢氧化钠溶液作用吸收过量的氯气,其反应的化学方程式Cl2+2NaOH=NaCl+NaClO+H2O.
(3)判断氯气已经收集满的标志是集气瓶充满黄绿色气体.
分析 实验室用加热二氧化锰与浓盐酸方法制取氯气,浓盐酸易挥发,制取的氯气中含有氯化和水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,选择饱和食盐水除去氯气中的氯化氢,浓硫酸具有吸水性,可以干燥氯气,氯气密度大于空气密度,应采用向上排空气法收集,氯气有毒,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收过量的氯气.
解答 解:(1)依据仪器形状可知A为分液漏斗,B为原地烧瓶;
故答案为:分液漏斗;圆底烧瓶;
(2)从C处出来的氯气中含有水蒸气,浓硫酸具有吸水性,可以干燥氯气;氯气有毒,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收过量的氯气,方程式::Cl2+2NaOH=NaCl+NaClO+H2O;
(3)氯气为黄绿色气体,密度大于空气密度,所以当收集满氯气时,集气瓶充满黄绿色气体;
故答案为:集气瓶充满黄绿色气体;
点评 本题考查了氯气的制备,熟悉实验室制备氯气的原理及氯气的性质是解题关键,侧重考查学生对基础知识的掌握熟练程度,题目难度不大.

练习册系列答案
相关题目
9.化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )
| A. | 小苏打--Na2CO3 | B. | 消石灰--Ca (OH)2 | C. | 甲醛--CH3OH | D. | 大理石--CaSO4 |
7.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
(1)化学反应速率本质上是由物质本身的性质决定的,但外界条件也会影响反应速率的大小.本实验中实验2和实验3表明:在其它条件相同时,温度对反应速率有影响.
(2)我们最好选取实验1、2、4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大,反应速率越快.
(3)利用表中数据,可以求得:硫酸的物质的量浓度是2_mol/L.
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 2.0 | 粉末 | 35 | 30 | m5 |
| 6 | 50.0 | 2.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 2.0 | 粉末 | 25 | t7 | 16.1 |
(2)我们最好选取实验1、2、4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大,反应速率越快.
(3)利用表中数据,可以求得:硫酸的物质的量浓度是2_mol/L.
14.下列不属于可逆反应的是( )
| A. | 2Na+2H2O?2NaOH+H2↑ | B. | Cl2+H2O?HCl+HClO | ||
| C. | NH3•H2O?NH3+H2O | D. | N2+3H2$?_{高温高压}^{催化剂}$2NH3 |