题目内容
溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
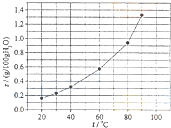

| A、溴酸银的溶解是放热过程 |
| B、温度升高时溴酸银溶解速度加快 |
| C、60℃时溴酸银的Ksp约等于6×10-4 |
| D、若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
考点:溶解度、饱和溶液的概念,难溶电解质的溶解平衡及沉淀转化的本质
专题:物质的量浓度和溶解度专题
分析:A.根据图象中温度对溴酸银的溶解度影响可知溴酸银的溶解过程为吸热过程;
B.温度升高,可以加快物质的溶解速率;
C.根据溶度积表达式及溶液中银离子和溴酸根离子的浓度计算;
D.溴酸银的溶解度受温度的影响较小,可以通过重结晶法分离硝酸钾与溴酸银的混合物.
B.温度升高,可以加快物质的溶解速率;
C.根据溶度积表达式及溶液中银离子和溴酸根离子的浓度计算;
D.溴酸银的溶解度受温度的影响较小,可以通过重结晶法分离硝酸钾与溴酸银的混合物.
解答:
解:A.根据图象可知,升高温度,溴酸银的溶解度增大,说明溴酸银的溶解过程为吸热过程,故A错误;
B.升高温度,溴酸银的溶解度增大,所以温度升高时溴酸银溶解速度加快,故B正确;
C.60℃时溴酸银的溶解度为0.6g,溴酸银的物质的量为:
≈2.5×10-3mol,100.6g溴酸银溶液的体积约为100.6mL,溶液中银离子、溴离子浓度约为2.5×10-2mol/L,所以60℃时溴酸银的Ksp=2.5×10-2×2.5×10-2≈6×10-4,故C正确;
D.根据图象可知,溴酸银的溶解度受温度的影响不大,而硝酸钾的溶解度受温度影响较大,所以硝酸钾中含有少量溴酸银,可用重结晶方法提纯,故D正确;
故选A.
B.升高温度,溴酸银的溶解度增大,所以温度升高时溴酸银溶解速度加快,故B正确;
C.60℃时溴酸银的溶解度为0.6g,溴酸银的物质的量为:
| 0.6g |
| 236g/mol |
D.根据图象可知,溴酸银的溶解度受温度的影响不大,而硝酸钾的溶解度受温度影响较大,所以硝酸钾中含有少量溴酸银,可用重结晶方法提纯,故D正确;
故选A.
点评:本题考查了难溶物的溶解平衡、溶度积的表达式及计算、物质的分离与提纯,题目难度中等,注意掌握难溶物的溶解平衡及其影响因素,明确溶度积的概念及计算方法.

练习册系列答案
相关题目
下列离子在水溶液中不发生水解的是( )
| A、Ag+ |
| B、I- |
| C、F- |
| D、CO32- |
2mol铝分别与足量盐酸和氢氧化钠溶液反应,消耗的HCl和NaOH物质的量之比为( )
| A、1:1 | B、2:1 |
| C、3:1 | D、1:3 |
下列有关化学键与晶体结构说法正确的是( )
| A、仅由非金属元素组成的晶体可能是离子晶体 |
| B、离子化合物的熔点一定比共价化合物的高 |
| C、离子化合物中不可能含共价键 |
| D、氯化氢溶于水能电离出H+,Cl-所以氯化氢是离子化合物 |
下列关于浓硫酸和浓硝酸的叙述正确的是( )
| A、浓硫酸具有吸水性,因而能使蔗糖炭化 |
| B、久置的浓硝酸会发黄,是因为HNO3不稳定,分解产生的NO2溶于其中 |
| C、常温下,浓硫酸和浓硝酸均可以与铜反应,放出气体 |
| D、常温下可用铁制容器运输浓硫酸和浓硝酸,是因为它们与铁不反应 |
已知:-CH2OH在一定条件下能被氧化成-CHO.分子式为C6H14O,且能被氧化成含有-CHO的同分异构体有(不考虑立体异构)( )
| A、6种 | B、7种 | C、8种 | D、9种 |
下列原子结构示意图所表示的元素,属于氧族元素的是( )
A、 |
B、 |
C、 |
D、 |
在标准状况下,有O2和CO2两种气体,测得它们的质量比为4:11,则它们的体积比为( )
| A、1:2 | B、5:6 |
| C、11:12 | D、1:1 |
下列说法正确的是( )
| A、将Ca(OH)2饱和溶液加热,溶液的pH增大 |
| B、常温下,pH=11的氨水与pH=3的盐酸等体积混合后,溶液的pH>7 |
| C、将0.1mol/L的HI溶液加水稀释l00倍,溶液中所有离子的浓度随之减小 |
| D、两种醋酸溶液的pH分别为a和(a+1),物质的量浓度分别为c1和c2,则有c1=10c2 |