题目内容
下列离子在水溶液中不发生水解的是( )
| A、Ag+ |
| B、I- |
| C、F- |
| D、CO32- |
考点:盐类水解的应用
专题:盐类的水解专题
分析:离子在水溶液中不发生水解,说明该离子是强酸根离子或强碱阳离子,据此分析解答.
解答:
解:A.银离子是弱碱阳离子,能发生水解,故A错误;
B.碘离子是强酸根离子,所以不能发生水解,故B正确;
C.氟离子是弱酸根离子,所以能发生水解,故C错误;
D.碳酸根离子是弱酸根离子,所以能发生水解,故D错误;
故选B.
B.碘离子是强酸根离子,所以不能发生水解,故B正确;
C.氟离子是弱酸根离子,所以能发生水解,故C错误;
D.碳酸根离子是弱酸根离子,所以能发生水解,故D错误;
故选B.
点评:本题考查了盐类水解,根据“谁弱谁水解、有弱才水解”来确定盐是否发生水解,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是( )
| A、MnO4-、K+、Na+、SO42- |
| B、Na+、K+、HCO3-、Cl- |
| C、Mg2+、NH4+、Cl-、NO3- |
| D、Ba2+、K+、S2-、SO42- |
与250mL 0.4mol/L稀硫酸中的c(H+)相等的是( )
| A、250mL 0.4mol/L的稀盐酸溶液 |
| B、25mL 0.8mol/L的稀硝酸溶液 |
| C、100mL 1mol/L的稀硫酸溶液 |
| D、100mL 2mol/L的盐酸溶液 |
下列各组微粒中,核外电子总数相等的是( )
| A、H2O和Al3+ |
| B、Cl-和Na+ |
| C、O2和CO2 |
| D、NH3和CO |
航天飞机常用肼(N2H4)和过氧化氢(H2O2)作动力源.已知1g液态肼和足量液态过氧化氢反应生成氮气和水蒸气放出20.05kJ热量.下列说法中错误的是( )
| A、该反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.6 kJ?mol-1 |
| B、该反应中肼作还原剂 |
| C、该动力源的突出优点之一是反应产物对环境无污染 |
| D、液态肼的燃烧热为-20.05 kJ?mol-1 |
金属钠与水反应实验过程中,难以反应出钠的某项物理性质的是( )
| A、钠可以用小刀顺利切割开来 |
| B、钠浮在水面上 |
| C、钠迅速熔化成闪亮的小球 |
| D、钠与冷水发生剧烈反应,放出大量气体 |
下列有关说法正确的是( )
| A、铁的冶炼过程是通过置换反应得到单质铁 |
| B、利用电解的方法可以从海水中获得淡水 |
| C、海水提溴的过程中不发生氧化还原反应 |
| D、以贝壳、海水、盐酸为原料提炼金属镁的过程中不涉及置换反应 |
溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
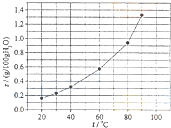

| A、溴酸银的溶解是放热过程 |
| B、温度升高时溴酸银溶解速度加快 |
| C、60℃时溴酸银的Ksp约等于6×10-4 |
| D、若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |