题目内容
下列有关化学键与晶体结构说法正确的是( )
| A、仅由非金属元素组成的晶体可能是离子晶体 |
| B、离子化合物的熔点一定比共价化合物的高 |
| C、离子化合物中不可能含共价键 |
| D、氯化氢溶于水能电离出H+,Cl-所以氯化氢是离子化合物 |
考点:化学键,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:A.仅由非金属元素组成的晶体可能是离子晶体,也可能是分子晶体或原子晶体;
B.离子化合物的熔点不一定比共价化合物的高;
C.离子化合物中可能含有共价键;
D.氯化氢属于共价化合物.
B.离子化合物的熔点不一定比共价化合物的高;
C.离子化合物中可能含有共价键;
D.氯化氢属于共价化合物.
解答:
解:A.仅由非金属元素组成的晶体可能是离子晶体,如铵盐,故A正确;
B.离子化合物的熔点不一定比共价化合物的高,如氯化钠的熔点低于二氧化硅,故B错误;
C.离子化合物中可能含有共价键,如KOH,故C错误;
D.氯化氢属于共价化合物,氯化氢中Cl原子和H原子通过共用电子对形成共价键,故D错误;
故选A.
B.离子化合物的熔点不一定比共价化合物的高,如氯化钠的熔点低于二氧化硅,故B错误;
C.离子化合物中可能含有共价键,如KOH,故C错误;
D.氯化氢属于共价化合物,氯化氢中Cl原子和H原子通过共用电子对形成共价键,故D错误;
故选A.
点评:本题考查了化学键和化合物的关系,根据物质的构成微粒及物质的性质来分析解答,易错选项是D.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
下列有关说法正确的是( )
| A、铁的冶炼过程是通过置换反应得到单质铁 |
| B、利用电解的方法可以从海水中获得淡水 |
| C、海水提溴的过程中不发生氧化还原反应 |
| D、以贝壳、海水、盐酸为原料提炼金属镁的过程中不涉及置换反应 |
在温度和压强不变的条件下,当氧气的物质的量发生改变时,下列物理量一定不改变的是( )
| A、质量、摩尔质量 |
| B、体积、摩尔质量 |
| C、分子数、电子数 |
| D、密度、摩尔体积 |
下列热化学方程式书写及说法正确的是( )
| A、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890 kJ | ||
B、C(s)+
| ||
C、2mol氢气燃烧得水蒸气放热484 kJ,则H2O(g)=H2(g)+
| ||
| D、Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l)△H=-2a kJ?mol-1,则任何强酸和强碱发生中和反应生成1mol H2O(l)的反应热均为-a kJ?mol-1 |
不能在有机物分子中直接引入羟基(-OH)官能团的反应类型是( )
| A、取代反应 | B、消去反应 |
| C、加成反应 | D、水解反应 |
溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
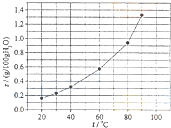

| A、溴酸银的溶解是放热过程 |
| B、温度升高时溴酸银溶解速度加快 |
| C、60℃时溴酸银的Ksp约等于6×10-4 |
| D、若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
下列各粒子:①H3O+、NH4+、Na+;②OH-、NH2-、F-;③O2-、Na+、Mg2+;④CH4、NH3、H2O具有相同质子数和电子数的正确一组是( )
| A、①②③ | B、①②④ |
| C、②③④ | D、①③④ |
用惰性电极电解硫酸铜溶液一段时间后,向电解池中加入0.2molCu(OH)2恰好恢复为电解前的浓度,则电解过程中转移电子的物质的量为( )
| A、0.8 mol |
| B、0.4 mol |
| C、0.2mol |
| D、0.6mol |