题目内容
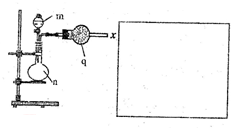 该小组的乙同学利用图所示装置制备并收集干燥的NO2气体.
该小组的乙同学利用图所示装置制备并收集干燥的NO2气体.①图中仪器n的名称是
②请在方框内画出用集气瓶收集NO2的装置图.
③写出仪器n中发生反应的离子方程式:
考点:常见气体制备原理及装置选择,氮的氧化物的性质及其对环境的影响
专题:氮族元素
分析:①根据装置图分析;
②根据气体的溶解性、密度选取合适的收集方法;
③铜和稀硝酸反应生成硝酸铜、一氧化氮和水.
②根据气体的溶解性、密度选取合适的收集方法;
③铜和稀硝酸反应生成硝酸铜、一氧化氮和水.
解答:
解:①由图可知B仪器是圆底烧瓶,故答案为:圆底烧瓶;
②二氧化氮气体易溶于水,所以不能用排水法收集;二氧化氮的密度大于空气的密度且和氧气不反应,所以可以采用向上排空气法收集,多余的二氧化氮用氢氧化钠溶液吸收,则集气瓶收集NO2的装置图为: ,故答案为:
,故答案为: ;
;
③铜和浓硝酸反应生成硝酸铜、二氧化氮和水,离子方程式为Cu+4H++2NO3-=Cu2++2H2O+2NO2↑,
故答案为:Cu+4H++2NO3-=Cu2++2H2O+2NO2↑.
②二氧化氮气体易溶于水,所以不能用排水法收集;二氧化氮的密度大于空气的密度且和氧气不反应,所以可以采用向上排空气法收集,多余的二氧化氮用氢氧化钠溶液吸收,则集气瓶收集NO2的装置图为:
 ,故答案为:
,故答案为: ;
;③铜和浓硝酸反应生成硝酸铜、二氧化氮和水,离子方程式为Cu+4H++2NO3-=Cu2++2H2O+2NO2↑,
故答案为:Cu+4H++2NO3-=Cu2++2H2O+2NO2↑.
点评:本题考查了二氧化氮的制备、收集和尾气处理,题目难度不大,会根据气体的溶解性、密度选取合适的收集方法.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
用水热法制备Fe3O4纳米颗粒的总反应如下:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O.下列说法正确的是( )
| A、在反应中硫元素被氧化,铁元素被还原 |
| B、还原剂是Fe2+,氧化剂是S2O32-和O2 |
| C、当转移1mol电子时,消耗56g S2O32- |
| D、每生成1mol Fe3O4,转移3mol电子 |
下列溶液中的氯离子浓度与50mL 1mol?L-1的AlCl3溶液中氯离子浓度相等的是( )
| A、150mL 1mol?L-1的NaCl |
| B、25mL 2mol?L-1的FeCl3 |
| C、150mL 3mol?L-1的KCl |
| D、75mL 2mol?L-1的CaCl2 |
下列递变规律正确的是( )
| A、HClO4、H3PO4、H2SiO3酸性依次增强 |
| B、O2-、Mg2+、Al3+的半径依次增大 |
| C、Na、Mg、Al还原性依次减弱 |
| D、HCl、HBr、HI稳定性依次增强 |
 已知在高温、高压、催化剂作用下,1mol石墨转化为金刚石,吸收1.9kJ的热量.
已知在高温、高压、催化剂作用下,1mol石墨转化为金刚石,吸收1.9kJ的热量. 某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: