题目内容
(1)5molCO2的质量是 g,在标准状况下所占体积为 L,所含分子数为 ,所含O原子数为 .
(2)0.5mol H2SO4 的质量是 g,能和 molNaOH完全反应,该硫酸所含氢元素的质量与 mol H3PO4或标准状况下 L HCl中所含氢元素的质量相同.
(3)19g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是 g/mol; ACl2的化学式是 .
(4)0.3mol的氧气和0.2mol的臭氧(O3),它们的质量 ,它们所含的分子数 ,原子数 ,(以上三空填“相等”或“不相等”)它们的体积比(同温、同压)是 .
(2)0.5mol H2SO4 的质量是
(3)19g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是
(4)0.3mol的氧气和0.2mol的臭氧(O3),它们的质量
考点:物质的量的相关计算
专题:计算题
分析:(1)利用m=n×M、V=n×Vm、N=n×NA及二氧化碳分子的构成来分析解答;,则n(O)=4n(H2SO4 ),再根据N=nNA计算氧原子数目;
(2)硫酸与NaOH按物质的量之比1:2反应,据此计算NaOH的物质的量;计算n(H3PO4)、n(HCl),再根据V=nVm计算HCl的体积;
(3)根据该二价金属氯化物的化学式计算出其物质的量,再根据M=
计算出ACl2的摩尔质量;根据计算结果推断A的名称并写出ACl2的化学式;
(4)根据m=n?M计算质量,然后作比较;根据N=n?NA计算分子数,然后作比较;根据V=n?Vm计算体积比.
(2)硫酸与NaOH按物质的量之比1:2反应,据此计算NaOH的物质的量;计算n(H3PO4)、n(HCl),再根据V=nVm计算HCl的体积;
(3)根据该二价金属氯化物的化学式计算出其物质的量,再根据M=
| m |
| n |
(4)根据m=n?M计算质量,然后作比较;根据N=n?NA计算分子数,然后作比较;根据V=n?Vm计算体积比.
解答:
解:(1)5molCO2的质量为5mol×44g/mol=220g,其标准状况下所占的体积为5mol×22.4L/mol=112L,
分子数为5×6.02×1023=3.01×1024,氧原子的数目为5×2×6.02×1023=6.02×1024,
故答案为:220g;112;3.01×1024;6.02×1024;
(2)0.5mol H2SO4 的质量=0.5mol×98g/mol=49g;
硫酸与NaOH按物质的量之比1:2反应,消耗NaOH的物质的量=2×0.5mol=1mol;
每个H2SO4分子含有2个H原子,则n(H)=2n(H2SO4 )=2×0.5mol=1mol,含有氢元素质量相等,则H原子物质的量相等,则n(H3PO4)=
×1mol=
mol,n(HCl)=1mol,V(HCl)=1mol×22.4L/mol=22.4L,
故答案为:49;1;
;22.4;
(3)19g某二价金属氯化物(ACl2)中含有0.4molCl-,该金属的氯化物的物质的量为:0.4mol×
=0.2mol,则ACl2的摩尔质量为:
=95g/mol,A的相对原子量为:95-71=24,A为Mg,ACl2的化学式为MgCl2,
故答案为:95;MgCl2;
(4)根据m=n?M可知,0.3molO2与0.2molO3的质量都为9.6g,故两者的质量相等,
根据N=n?NA可知,0.3molO2与0.2molO3所含的分子数分别为0.3NA,0.2NA,则分子数不等,
0.3mol的氧气和0.2mol的臭氧(O3),原子数都是0.6mol,
根据V=n?Vm可知,同温同压的体积之比等于物质的量之比,所以体积之为3:2,
故答案为:相等;不相等;相等;3:2.
分子数为5×6.02×1023=3.01×1024,氧原子的数目为5×2×6.02×1023=6.02×1024,
故答案为:220g;112;3.01×1024;6.02×1024;
(2)0.5mol H2SO4 的质量=0.5mol×98g/mol=49g;
硫酸与NaOH按物质的量之比1:2反应,消耗NaOH的物质的量=2×0.5mol=1mol;
每个H2SO4分子含有2个H原子,则n(H)=2n(H2SO4 )=2×0.5mol=1mol,含有氢元素质量相等,则H原子物质的量相等,则n(H3PO4)=
| 1 |
| 3 |
| 1 |
| 3 |
故答案为:49;1;
| 1 |
| 3 |
(3)19g某二价金属氯化物(ACl2)中含有0.4molCl-,该金属的氯化物的物质的量为:0.4mol×
| 1 |
| 2 |
| 19g |
| 0.2mol |
故答案为:95;MgCl2;
(4)根据m=n?M可知,0.3molO2与0.2molO3的质量都为9.6g,故两者的质量相等,
根据N=n?NA可知,0.3molO2与0.2molO3所含的分子数分别为0.3NA,0.2NA,则分子数不等,
0.3mol的氧气和0.2mol的臭氧(O3),原子数都是0.6mol,
根据V=n?Vm可知,同温同压的体积之比等于物质的量之比,所以体积之为3:2,
故答案为:相等;不相等;相等;3:2.
点评:本题考查有关物质的量的计算,明确质量、体积、物质的量、摩尔质量、摩尔体积的关系即可解答,难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
2.3g钠投入100g水中,下列叙述述错误的是( )
| A、钠浮在水面,熔化成银色光亮的小球 |
| B、钠贮存在煤油中 |
| C、所得溶液的质量分数为2.25% |
| D、反应中转移0.1mol电子 |
下列说法不正确的是( )
| A、体系有序性越高,熵值就越低 |
| B、自发过程将导致体系的熵增大 |
| C、吸热反应不可以自发进行 |
| D、同种物质气态时熵值最大 |
下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
| A、碘与干冰分别受热变为气体 |
| B、硝酸铵与硝酸分别受热变为气体 |
| C、氯化钠与氯化氢分别溶解在水中 |
| D、二氧化硅晶体与冰分别受热熔化 |
下列叙述正确的是( )
| A、同种元素的原子均具有相同的质子数和中子数 |
| B、不同元素的原子构成的分子只含极性键 |
| C、第三周期中的非金属元素的气态氢化物还原性越强,对应元素的最高价含氧酸酸性越弱 |
| D、第ⅠA族和第ⅦA族元素从上到下随原子序数递增,单质的沸点均逐渐升高 |

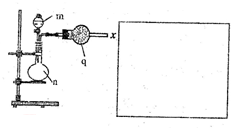 该小组的乙同学利用图所示装置制备并收集干燥的NO2气体.
该小组的乙同学利用图所示装置制备并收集干燥的NO2气体.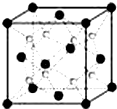 A~G是前四周期原子序数依次增大的七种元素.A、C的价电子层中未成对电子数都是2;D+与C的简单离子具有相同离子结构;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G为周期表第11列元素.回答下列问题:
A~G是前四周期原子序数依次增大的七种元素.A、C的价电子层中未成对电子数都是2;D+与C的简单离子具有相同离子结构;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G为周期表第11列元素.回答下列问题: