题目内容
取50.0mL K2CO3和K2SO4的混合溶液,加入过量BaCl2溶液后得到12.18g白色沉淀,用过量稀硝酸处理后沉淀量减少到2.33g,并有气体放出.试计算:(请写出计算过程)
(1)原混合溶液中K2CO3和K2SO4的物质的量浓度.
(2)产生的气体在标准状况下的体积.
(1)原混合溶液中K2CO3和K2SO4的物质的量浓度.
(2)产生的气体在标准状况下的体积.
考点:离子方程式的有关计算
专题:计算题
分析:发生反应有:Na2CO3+BaCl2=BaCO3↓+2NaCl,Na2SO4+BaCl2=BaSO4↓+2NaCl,BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O.12.18g白色沉淀是碳酸钡、硫酸钡的质量之和,用过量稀硝酸处理后沉淀量减少到2.33g,为硫酸钡的质量,故碳酸钡的质量为12.18g-2.33g=9.85g,根据n=
计算碳酸钡、硫酸钡的物质的量,
(1)根据守恒计算n(Na2CO3)、n(Na2SO4),再根据c=
计算;
(2)根据碳原子守恒可知n(CO2)=n(Na2CO3),根据V=nVm计算二氧化碳的体积.
| m |
| M |
(1)根据守恒计算n(Na2CO3)、n(Na2SO4),再根据c=
| n |
| V |
(2)根据碳原子守恒可知n(CO2)=n(Na2CO3),根据V=nVm计算二氧化碳的体积.
解答:
解:发生反应有:Na2CO3+BaCl2=BaCO3↓+2NaCl,Na2SO4+BaCl2=BaSO4↓+2NaCl,BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O.12.18g白色沉淀是碳酸钡、硫酸钡的质量之和,用过量稀硝酸处理后沉淀量减少到2.33g,为硫酸钡的质量,故n(BaSO4)=
=0.01mol,故碳酸钡的质量为12.18g-2.33g=9.85g,故n(BaCO3)=
=0.05mol,
(1)根据守恒n(Na2CO3)=n(BaCO3)=0.05mol,故c(Na2CO3)=
=1mol/L,
n(Na2SO4)=n(BaSO4)=0.01mol,故c(Na2SO4)=
=0.2mol/L,
答:原混和溶液中Na2CO3和Na2SO4的物质的量浓度分别为1mol/L、0.2mol/L;
(2)根据碳原子守恒可知n(CO2)=n((BaCO3)=0.05mol,故二氧化碳的体积为v(CO2)=0.05mol×22.4L/mol=1.12L,答:二氧化碳的体积为1.12L.
| 2.33g |
| 233g/mol |
| 9.85g |
| 197g/mol |
(1)根据守恒n(Na2CO3)=n(BaCO3)=0.05mol,故c(Na2CO3)=
| 0.05mol |
| 0.05L |
n(Na2SO4)=n(BaSO4)=0.01mol,故c(Na2SO4)=
| 0.01mol |
| 0.05L |
答:原混和溶液中Na2CO3和Na2SO4的物质的量浓度分别为1mol/L、0.2mol/L;
(2)根据碳原子守恒可知n(CO2)=n((BaCO3)=0.05mol,故二氧化碳的体积为v(CO2)=0.05mol×22.4L/mol=1.12L,答:二氧化碳的体积为1.12L.
点评:本题考查混合物的有关计算,难度不大,清楚发生反应是解题关键,注意守恒思想的利用.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、手性异构体性质相同 |
| B、互为手性异构体的分子互为镜像 |
| C、手性异构体分子组成相同 |
| D、手性催化剂只催化或主要催化一种手性分子的合成 |
下列说法正确的是( )
| A、1mol氧的质量是16g?mol-1 |
| B、Na+的摩尔质量是23g?mol-1 |
| C、CO2的摩尔质量是44g |
| D、氢的摩尔质量是2g?mol-1 |
已知4g RO32-中核外电子数比质子数多6.02×1022个,则元素R的相对原子质量为( )
| A、12 | B、27 | C、32 | D、80 |

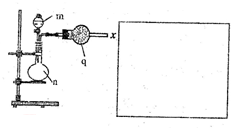 该小组的乙同学利用图所示装置制备并收集干燥的NO2气体.
该小组的乙同学利用图所示装置制备并收集干燥的NO2气体.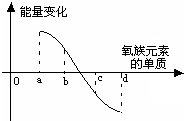 元素周期律是指导我们学习元素及其化合物知识的重要工具.已知氧族元素(不含Po)的部分知识如下表所示,
元素周期律是指导我们学习元素及其化合物知识的重要工具.已知氧族元素(不含Po)的部分知识如下表所示,